
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
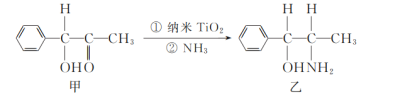
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
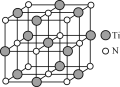
【答案】1s22s22p62s23p63d2或[Ar]3d2 NH4+ Ti<B<H 5 16mol Ti4CN3
【解析】
(1)①钛是22号元素,Ti2+核外有20个电子;②BH4-含有5个原子,价电子总数为8,据此分析书写与BH4-互为等电子体的阳离子;③根据第一电离能的变化规律分析判断H、B、Ti原子的第一电离能的大小顺序;
(2)采取sp3杂化方式的原子的价层电子对数=4,据此分析判断分子中采取sp3杂化方式的原子个数;
(3) 配位键属于σ键,1个单键为1个σ键,据此分析判断;
(4)根据均摊法计算晶胞中碳、氮、钛原子数目,进而确定化学式。
(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为:1s22s22p63s23p63d2,故答案为:1s22s22p63s23p63d2;
②BH4-含有5个原子,价电子总数为8,与BH4-互为等电子体的阳离子为NH4+,故答案为:NH4+;
③同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素。同族元素,从上至下第一电离能逐渐减小,金属元素的第一电离能小于非金属元素,H、B、Ti原子的第一电离能由小到大的顺序为Ti<B<H,故答案为:Ti<B<H;
(2)化合物乙(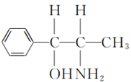 )的分子中采取sp3杂化方式的原子个数有
)的分子中采取sp3杂化方式的原子个数有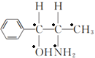 (标记为●的原子采取sp3杂化),共5个,故答案为:5;
(标记为●的原子采取sp3杂化),共5个,故答案为:5;
(3) 1个[Ti(OH)2(H2O)4]2+中含有6个配位键,10个O-H,因此1mol[Ti(OH)2(H2O)4]2+中含有σ键的数目为16mol,故答案为:16mol;
(4) 某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞顶点的氮原子,利用均摊法可知,晶胞中含有碳原子数为8×![]() =1,含有氮原子数为6×
=1,含有氮原子数为6×![]() =3,含有钛原子数为12×
=3,含有钛原子数为12×![]() +1=4,所以碳、氮、钛原子数之比为1∶3∶4,则该化合物的化学式为Ti4CN3,故答案为:Ti4CN3。
+1=4,所以碳、氮、钛原子数之比为1∶3∶4,则该化合物的化学式为Ti4CN3,故答案为:Ti4CN3。


科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用磷肥副产物氟硅酸钠(Na2SiF6)为原料合成冰晶石(Na3AlF6)成为一条合理利用资源、提高经济效益的新方法。工艺流程如下图所示:
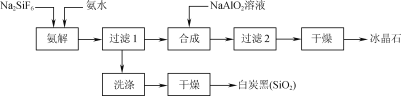
(1)传统合成冰晶石的方法是萤石(CaF2)法:使用萤石、石英和纯碱在高温下煅烧生成NaF,在NaF溶液中加入Al2(SO4)3溶液制得。在加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,
否则可能产生副产物____(填物质的化学式),但酸度不宜过强的原因是____。
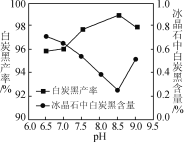
(2)氨解时白炭黑产率和冰晶石纯度与pH的关系如图,氨解时需要控制溶液的pH=____;能提高氨解速率的措施有____(填字母)。
A.快速搅拌
B.加热混合液至100℃
C.减小氨水浓度
(3)工艺流程中氨解反应的化学方程式为____;冰晶石合成反应的离子方程式为______。
(4)为了提高原料利用率,减少环境污染,可采取的措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液)。

(1)锥形瓶内装有某种可溶性正盐固体(含有3种酸的酸根的其中一种),此固体为________,分液漏斗中所盛试剂是___。
(2)装置B中所盛试剂的名称是________,试剂的作用是__________。
(3)装置C中出现的现象是__________________。
(4)由实验可知三种酸的酸性大小顺序为________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
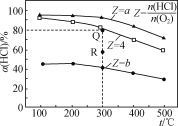
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和氮及其化合物在生产生活中应用广泛。请回答:
(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)工业上可以通过氮气和氢气在一定条件下合成氨气。下列关于氨气的性质和用途描述正确的是____________。
A.氨气易液化,液氨可作制冷剂 B.可用排水法收集氨气
C.氨气是一种无色无味的气体 D.向氨水中滴加酚酞,溶液变红
(5)实验室检验试管里氨气是否收集满的方法是___________________(写出一种即可)。
(6)汽车尾气常含有NO、NO2、CO等,会污染空气。在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案不能达到实验目的的是( )

A. 图A装置——Cu和稀硝酸制取NOB. 图B装置——检验乙炔的还原性
C. 图C装置——实验室制取溴苯D. 图D装置——实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:C(氯化亚铁溶液)、D(碘化钾淀粉溶液)、E(紫色石蕊试液)、G(含酚酞的氢氧化钠溶液)

(1)A是氯气的发生装置,反应的离子方程式为________________________。
(2)a仪器的名称为_________________,B中宜加入的液体是_________________。
(3)实验开始后C中反应的离子方程式是________________________________,D中的现象是___________________,E中的现象是____________________________。
(4)F装置中硬质玻璃管内盛有炭粉,若F中发生氧化还原反应,其产物为二氧化碳和氯化氢,则F中反应的化学方程式为___________________________________________。
(5)G中发生氧化还原反应的离子方程式为________________________________。
(6)F处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是____________________________;若发现装置B中该现象不明显,可能的原因是A或B装置漏气,查找原因时若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com