
【题目】用下列实验方案不能达到实验目的的是( )

A. 图A装置——Cu和稀硝酸制取NOB. 图B装置——检验乙炔的还原性
C. 图C装置——实验室制取溴苯D. 图D装置——实验室分离CO和CO2
科目:高中化学 来源: 题型:
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。

① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。

据图回答下列问题:
(1)写出A、C、D的结构简式:
A________,C________,D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________(反应类型____________)。
②________________________________(反应类型____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
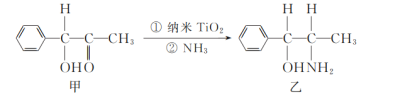
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
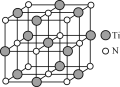
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1molCH4和0.1molCl2充分反应,生成的C-Cl键和H-Cl键的数目均为0.2NA
B. 7.8gNa2S和Na2O2的混合物中所含阴离子的数目等于0.2NA
C. 18g固态水(冰)中含有的氢键的数目为2NA
D. 25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中Ag+数目为1.0×10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是s能级和p能级的电子云轮廓图,试回答问题。


(1)s电子云轮廓图呈________形,每个s能级有________个原子轨道;p电子云轮廓图呈________状,每个p能级有________个原子轨道,其能量关系为____________(填“相同”或“不相同”)。
(2)元素X的原子最外层的电子排布式为nsnpn+1,原子中能量最高的是________电子;元素X的名称是____,它的氢化物的电子式是________。
(3)若元素Y的原子最外层的电子排布式为nsn-1npn+1,那么Y的元素符号应为________,原子的电子排布图为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大。)请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→___→___→__→__→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式____。
(3)能证明反应中有CO生成的现象是_____。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为____,步骤④中达到滴定终点的现象为_____。
(5)产品中氯元素的质量分数为_______。
(6)下列操作,可能引起测得产品中氯含量偏高是_____。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
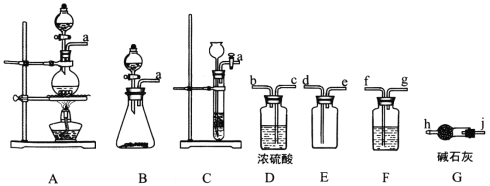
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的离子方程式为___________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
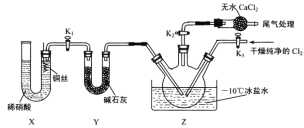
①实验室也可用 B 装置制备 NO , X装置的优点为___________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是____________,然后进行其他操作,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。
①设计实验证明 HNO2是弱酸:_____________。(仅提供的试剂:1 molL-1盐酸、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是__________,亚硝酰氯(ClNO)的质量分数为_________。(已知: Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 2 | 4 | 6 | 8 |
n(SO3) / mol | 0 | 0. 8 | 1. 4 | 1.8 | 1.8 |
下列说法正确的是
A. 反应在前2 s 的平均速率v(O2) = 0. 4 mol·L-1·s-1
B. 保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C. 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D. 保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com