
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大。)请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→___→___→__→__→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式____。
(3)能证明反应中有CO生成的现象是_____。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为____,步骤④中达到滴定终点的现象为_____。
(5)产品中氯元素的质量分数为_______。
(6)下列操作,可能引起测得产品中氯含量偏高是_____。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
【答案】E H J H 将BCl3冷凝为液态分离出来 BCl3+3H2O=H3BO3+3HCl F中黑色固体变成红色且澄清石灰水变浑浊 酸式滴定管或移液管 当滴入最后一滴KSCN溶液时,混合液由无色变为红色且半分钟内不褪色 ![]() B
B
【解析】
(1)干燥的氯气、B2O3、C反应生成BCl3和CO,BCl3的熔点为-107.3℃,沸点为12.5℃,收集三氯化硼要用冰水冷却,未反应的氯气用氢氧化钠溶液吸收,三氯化硼易水解,为防止氢氧化钠溶液中的水进入装置E,在E和J之间加H装置,用于吸水,生成的CO经干燥后在通过F装置还原氧化铜,再将生成的气体通过澄清的石灰水检验,可以证明原反应中有CO生成,多余的CO不能排放到空气中,要排水法收集。
(2)BCl3接触潮湿空气时会形成白雾,是三氯化硼水解生成HCl,HCl溶于空气中的水形成盐酸小液滴从而形成白雾;
(3)CO能还原氧化铜,使黑色的氧化铜生成红色的铜单质,CO自身被氧化成二氧化碳,能使澄清的石灰水变浑浊;
(4)根据Fe3+、SCN-反应产生血红色物质判断滴定终点;
(5)(6)根据n(Ag+)=n(Cl-)+n(SCN-),可计算出溶液中10.00mL溶液中含有的n(Cl-),然后计算mg即100mL中含有的n(Cl-),从而计算出其质量分数,根据v=n/V进行误差分析。据此解答。
(1)干燥的氯气、B2O3、C反应生成BCl3和CO,BCl3的熔点为-107.3℃,沸点为12.5℃,收集三氯化硼要用冰水冷却,未反应的氯气用氢氧化钠溶液吸收,三氯化硼易水解,为防止氢氧化钠溶液中的水进入装置E,在E和J之间加H装置,用于吸水,生成的CO经干燥后在通过F装置还原氧化铜,再将生成的气体通过澄清的石灰水检验,可以证明原反应中有CO生成,多余的CO不能排放到空气中,要排水法收集。则该实验装置中合理的连接顺序为G→_E__→_H__→_J_→H__→F→D→I;其中装置E的作用是将BCl3冷凝为液态分离出来。本小题答案为:E 、H 、J 、H ;将BCl3冷凝为液态分离出来。
(2)BCl3接触潮湿空气时会形成白雾,是三氯化硼水解生成HCl,HCl溶于空气中的水形成盐酸小液滴形成白雾,则三氯化硼水解的化学方程式为BCl3+3H2O=H3BO3+3HCl。本小题答案为:BCl3+3H2O=H3BO3+3HCl。
(3)CO能还原氧化铜,使黑色的氧化铜生成红色的铜单质,CO自身被氧化成二氧化碳,能使澄清的石灰水变浑浊,则能证明反应中有CO生成的现象是F中黑色固体变成红色且澄清石灰水变浑浊。本小题答案为:F中黑色固体变成红色且澄清石灰水变浑浊。
(4)步骤②移取溶液时所需仪器名称为酸式滴定管或移液管;用KSCN标准溶液滴定过量的AgNO3溶液,当硝酸银恰好反应完时,再滴入KSCN标准溶液,KSCN遇硝酸铁会生成硫氰化铁血红色溶液,则步骤④中达到滴定终点的现象为当滴入最后一滴KSCN溶液时,混合液由无色变为红色且半分钟内不褪色。本小题答案为:酸式滴定管或移液管;当滴入最后一滴KSCN溶液时,混合液由无色变为红色且半分钟内不褪色。
(5)消耗的硫氰化钾的物质的量为10-3C2V2mol/L,则过量的硝酸银的物质的量为10-3C2V2mol/L,则与产品中的氯离子反应的硝酸银的物质的量为(10-3C1V1-10-3C2V2)mol/L,则10.00mL该产品溶液中的氯离子的物质的量也为(10-3C1V1-10-3C2V2)mol/L,100.00mL该产品溶液中的氯离子的物质的量也为(10-2C1V1-10-2C2V2)mol/L,质量为35.5(10-2C1V1-10-2C2V2)g,产品中氯元素的质量分数为[35.5(10-2C1V1-10-2C2V2)/m]×100%,即![]() 。本小题答案为:
。本小题答案为:![]() 。
。
(6)A. 步骤③中未加硝基苯,会使一部分氯化银转化为硫氰化银,导致n(SCN-)增大,根据关系式n(Ag+)=n(Cl-)+n(SCN-)可知样品中含有的n(Cl-)偏小,故A不符合题意;
B. 步骤①中配制100mL溶液时,定容时俯视刻度线,则使c(Cl-)偏大,等体积时含有的n(Cl-)偏大,故 B符合题意;
C. 用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡,气泡占一定的体积,则读出KSCN溶液的体积偏大,消耗KSCN的物质的量偏大,根据KSCN计算出剩余的AgNO3的物质的量偏大,则与产品反应的硝酸银的物质的量偏小,则与硝酸银反应的氯离子的物质的量偏小,则测得产品中氯含量偏低,故 C不符合题意;
D. /span>滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴,消耗KSCN的物质的量偏大,根据KSCN计算出剩余的AgNO3的物质的量偏大,则与产品反应的硝酸银的物质的量偏小,则与硝酸银反应的氯离子的物质的量偏小,则测得产品中氯含量偏低,故 D不符合题意。答案选B。


科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
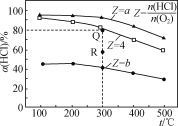
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案不能达到实验目的的是( )

A. 图A装置——Cu和稀硝酸制取NOB. 图B装置——检验乙炔的还原性
C. 图C装置——实验室制取溴苯D. 图D装置——实验室分离CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种主族元素在周期表里的相对位置如下图所示,已知它们的原子序数总和为46。

(1)M与Y形成的化合物中含________键,属__________分子。(填“极性”或“非极性”)
(2)N元素形成的单质分子中的化学键类型及数目是__________________(填“σ键”或“π键”)。在化学反应中________易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为_________________。其中的化学键有__________________________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式_____________。
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中:
质子数 | 16 | 16 | 16 |
电子数 | 16 | 17 | 18 |
化学式 | _______ | ________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:C(氯化亚铁溶液)、D(碘化钾淀粉溶液)、E(紫色石蕊试液)、G(含酚酞的氢氧化钠溶液)

(1)A是氯气的发生装置,反应的离子方程式为________________________。
(2)a仪器的名称为_________________,B中宜加入的液体是_________________。
(3)实验开始后C中反应的离子方程式是________________________________,D中的现象是___________________,E中的现象是____________________________。
(4)F装置中硬质玻璃管内盛有炭粉,若F中发生氧化还原反应,其产物为二氧化碳和氯化氢,则F中反应的化学方程式为___________________________________________。
(5)G中发生氧化还原反应的离子方程式为________________________________。
(6)F处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是____________________________;若发现装置B中该现象不明显,可能的原因是A或B装置漏气,查找原因时若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究处理NOx、SO2,对环境保护有着重要的意义。回答下列问题:
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:① SO2(g) + NH3H2O(aq) =NH4HSO3(aq) △H1 = a kJmol-1;② NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)△H2 = b kJmol-1;③ 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) △H3= c kJmol-1,则反应 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) △H = ______。
(2)NOx的排放主要来自于汽车尾气,有人利用反应C (s) + 2NO(g)![]() N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
N2(g) + CO2(g) △H=-34.0 kJmol-1,用活性炭对NO进行吸附。在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率 α(NO)随温度的变化如图所示:
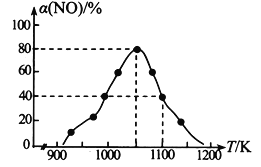
①由图可知,1050K前反应中NO的转化率随温度升高而增大,原因是_________________________; 在1100K 时,CO2的体积分数为______。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa 时,该反应的化学平衡常数Kp=________(已知:气体分压=气体总压×体积分数)。
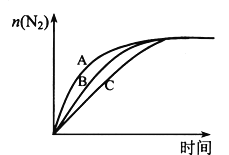
(3)在高效催化剂的作用下用CH4还原NO2,也可消除氮氧化物的污染。在相同条件下,选用A、B、C三种不同催化剂进行反应,生成 N2的物质的量与时间变化关系如图所示,其中活化能最小的是_________(填字母标号)。
(4)在汽车尾气的净化装置中 CO和NO发生反应:2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g) + 2CO2(g) △H2 =-746.8 kJmol-1。实验测得,υ正=k正c2(NO) c2(CO) ,υ逆=k逆c(N2) c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填" >”、“< ”或“=”) k逆增大的倍数。
②若在1L 的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =_____(保留2位有效数字)。
=_____(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用Pt/Al2O3、Pd/C、 Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2 (g)+CO(g)CH3OH(g)
(1)下表所列数据是各化学键的键能,该反应的ΔH=_______(用含字母的代数式表示)。
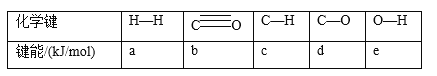
(2)某科研小组用Pd/C作催化剂,在450℃时,研究了n(H):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图),则图中表示n(H2):n(CO)=3:1的变化曲线为______(填“曲线a"或“曲线b”)。
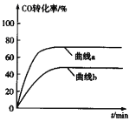
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2L的恒容密闭容器内充入1 mol CO和2molH2,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,CO的平均反应速率为________,该温度下的平衡常数K为_______.
(4)将CO和H2加入密闭容器中,在一定条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。平衡时CO的体积分数(%)与温度和压强的关系如下图所示(虚线框表示没有测定该条件下的数据)。
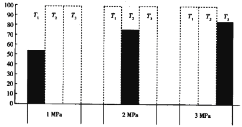
T1、T2、T3由大到小的关系是_________,判断理由是____________
(5)美国的两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图
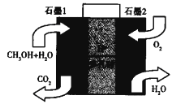
①石墨2为__________ (填“正“或“负“)极。
②石墨1极发生的电极反应式为________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com