
【题目】有Ⅰ~Ⅳ四个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
2Cl2(g)+2H2O(g);ΔH,HCl的平衡转化率(α)与Z和温度(t)的关系如图所示。下列说法正确的是( )
容器 | 起始时 | ||
t/℃ | n(HCl)/mol | Z | |
Ⅰ | 300 | 0.25 | a |
Ⅱ | 300 | 0.25 | b |
Ⅲ | 300 | 0.25 | 4 |
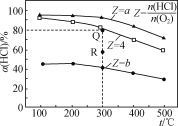
A. ΔH<0,a<4<b
B. 300℃该反应的平衡常数的值为64
C. 容器Ⅲ某时刻处在R点,则R点的υ正>υ逆,压强:p(R)>p(Q)
D. 若起始时,在容器Ⅳ中充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中c(HCl)=0.1mol·L-1
【答案】AC
【解析】
A.图像中HCl转化率随温度升高而减小,说明升温平衡逆向移动,正反应为放热反应△H<0,增大氧气的物质的量,可促进HCl的转化,即投料比越小,HCl转化率越大,可知a<4<b,故A正确;
B.300℃时,Z=![]() =4,n(HCl)=0.25mol,n(O2)=0.0625mol,体积为0.5L,c(HCl)=0.5mol/L,n(O2)=0.125mol/L,HCl转化率80%,HCl的变化量为0.5 mol/L×80%=0.4 mol/L,
=4,n(HCl)=0.25mol,n(O2)=0.0625mol,体积为0.5L,c(HCl)=0.5mol/L,n(O2)=0.125mol/L,HCl转化率80%,HCl的变化量为0.5 mol/L×80%=0.4 mol/L,
4HCl(g)+O2(g)2Cl2 (g)+2H2O(g)
起始量(mol/L)0.5 0.125 0 0
变化量(mol/L) 0.4 0.1 0.2 0.2
平衡量(mol/L)0.1 0.0250.2 0.2
K=![]() =640,故B错误;
=640,故B错误;
C.容器III,Z为4,平衡转化率为80%,R点温度与Q点相同,但转化率不同,转化率小于平衡时转化率,可知R点未达到平衡状态,反应正向进行,则R点的υ(正)>υ(逆),此时压强大于平衡状态下的压强:p(R)>p(Q),故C正确;
D.若起始时,在0.5 L容器Ⅳ中只充入0.25molCl2和0.25moIH2O(g),等效于在0.5L容器中充入0.5molHCl和0.125molO2,充入的HCl和O2物质的量为容器III的两倍,相当于在容器III的基础上增大压强,将体积缩小为原来的1/2,增大压强平衡正向移动,300℃达到平衡时0.1mol/L<c(HCl)<0.2mol/L,故D错误;
答案选AC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
金属离子 | Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?________________________________,该反应的离子方程式为_________________________________。
(2)溶液II中除Cu2+外,还有______金属离子,检验试剂为______________。物质Y不能为下列的________________________。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
(3)常温下,除去CuCl2溶液中的Fe2+,加入氧化剂X,使Fe2+氧化为Fe3+,然后加入物质Y至溶液pH=4,此时c(Fe3+)=_________mol/L,[已知Fe(OH)3的Ksp=4×10-38]
(4)若在空气中加热固体CuCl2·2H2O,可水解生成Cu(OH)Cl,写出相关的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:①饱和NaClO溶液pH为11;
②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7.结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为_________。
②盖紧瓶塞并在暗处反应的原因__________滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。

据图回答下列问题:
(1)写出A、C、D的结构简式:
A________,C________,D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________(反应类型____________)。
②________________________________(反应类型____________)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是甲、乙、丙三位同学制取乙酸乙酯的实验过程,请完成相关问题。
(实验目的)制取乙酸乙酯
(实验原理)甲、乙、丙三位同学均采用乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯
(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:

请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃导管改成了球形干燥管,除起冷凝作用外,另一重要作用是________________。
(实验步骤)
(1)按所选择的装置组装仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2mL冰醋酸,加入2~3块碎瓷片;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
(问题讨论)
a.步骤(1)组装实验装置,加入药品前还应检查________;
b.写出试管①中发生反应的化学方程式(注明反应条件):________________;
c.试管②中饱和Na2CO3溶液的作用是________________;
d.从试管②中分离出乙酸乙酯的实验操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
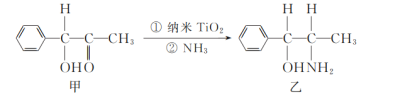
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
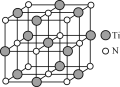
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1molCH4和0.1molCl2充分反应,生成的C-Cl键和H-Cl键的数目均为0.2NA
B. 7.8gNa2S和Na2O2的混合物中所含阴离子的数目等于0.2NA
C. 18g固态水(冰)中含有的氢键的数目为2NA
D. 25℃时,Ksp(AgI)=1.0×10-16,则AgI饱和溶液中Ag+数目为1.0×10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。(已知:BCl3的熔点为-107.3℃,沸点为12.5℃;硝基苯的密度比水大。)请回答下列问题:

实验Ⅰ:制备BCl3并验证产物CO
(1)该实验装置中合理的连接顺序为G→___→___→__→__→F→D→I;其中装置E的作用是______。
(2)BCl3接触潮湿空气时会形成白雾,请写出该反应的化学方程式____。
(3)能证明反应中有CO生成的现象是_____。
实验Ⅱ:产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2mL。
已知:Ksp(AgCl)>Ksp(AgSCN)。
(4)步骤②移取溶液时所需仪器名称为____,步骤④中达到滴定终点的现象为_____。
(5)产品中氯元素的质量分数为_______。
(6)下列操作,可能引起测得产品中氯含量偏高是_____。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可以衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示(部分反应条件、产物省略):(已知 2R-CHO + O2→2R-COOH R为烃基)
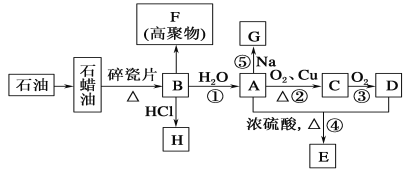
回答下列问题:
(1)①决定化合物A的化学特性的原子团的名称为________;F的结构简式为______________。
②B到A的反应类型为________,A到C的反应类型为________;
(2)写出下列反应的化学方程式:
反应②:______________________________________,
反应⑤:________________________________________。
(3)工业上制备H有以下两种方案:
Ⅰ.乙烷与氯气反应; Ⅱ.乙烯与氯化氢反应。
你认为最合理的方案是(填代号)________,理由是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com