
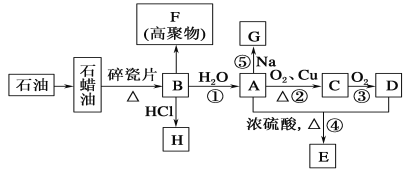
����Ŀ����֪A�ǻ�ѧʵ������������л����������ˮ����������ζ��B�IJ������Ժ���һ������ʯ�ͻ�����չ��ˮƽ���й����ʵ�ת����ϵ��ͼ��ʾ(���ַ�Ӧ����������ʡ��)��(��֪ 2R-CHO + O2��2R-COOH RΪ����)
�ش��������⣺
(1)�پ���������A�Ļ�ѧ���Ե�ԭ���ŵ�����Ϊ________��F�Ľṹ��ʽΪ______________��
��B��A�ķ�Ӧ����Ϊ________��A��C�ķ�Ӧ����Ϊ________��
(2)д�����з�Ӧ�Ļ�ѧ����ʽ��
��Ӧ����______________________________________��
��Ӧ����________________________________________��
(3)��ҵ���Ʊ�H���������ַ�����
��.������������Ӧ�� ��.��ϩ���Ȼ��ⷴӦ��
����Ϊ������ķ�����(�����)________��������_________________________��
���𰸡��ǻ� ![]() �ӳɷ�Ӧ ������Ӧ 2CH3CH2OH��O2
�ӳɷ�Ӧ ������Ӧ 2CH3CH2OH��O2![]() 2CH3CHO��2H2O 2CH3CH2OH��2Na�D��2CH3CH2ONa��H2�� �� ������������������ȡ����Ӧ������Ӧ�࣬���ﲻ�������ʵͣ���ϩ���Ȼ��ⷢ�����Ǽӳɷ�Ӧ�����﴿�������ʸ�
2CH3CHO��2H2O 2CH3CH2OH��2Na�D��2CH3CH2ONa��H2�� �� ������������������ȡ����Ӧ������Ӧ�࣬���ﲻ�������ʵͣ���ϩ���Ȼ��ⷢ�����Ǽӳɷ�Ӧ�����﴿�������ʸ�
��������
����A�ǻ�ѧʵ������������л����������ˮ����������ζ�����Ƴ�A���Ҵ���B�IJ���������������һ�����ҵ�ʯ�ͻ���ˮƽ��B����ϩ��Ȼ������й����ʵ�������һ���з������
A�ǻ�ѧʵ������������л����������ˮ����������ζ����֪A���Ҵ���B�IJ���������������һ�����ҵ�ʯ�ͻ���ˮƽ����BΪ��ϩ���ṹ��ʽ��CH2=CH2����ϩ��ˮ�����ӳɷ�Ӧ����AΪCH3CH2OH���Ҵ���Cu��Ag�����������·���������Ӧ����CΪCH3CHO��CH3CHO�ɽ�һ����������DΪCH3COOH��CH3CH2OH��CH3COOH��Ũ������ͼ��������£�����������Ӧ����Ӧ��������������ˮ����EΪCH3COOCH2CH3����ϩ��HCl��һ�������·����ӳɷ�Ӧ����HΪCH3CH2Cl��CH2=CH2Ҳ������һ�������·����Ӿ۷�Ӧ�����߾���F�Ǿ���ϩ��![]() ��
��
(1)��AΪCH3CH2OH�����������ǻ�������������A�Ļ�ѧ���Ե�ԭ���ŵ�����Ϊ�ǻ���F�Ǿ���ϩ����ṹ��ʽΪ![]() ��
��
��CH2=CH2��ˮ�����ӳɷ�Ӧ�������Ҵ�������B��A�ķ�Ӧ����Ϊ���ӳɷ�Ӧ���Ҵ���O2��Cu��Ag�����������·���������Ӧ����CΪCH3CHO������A��C�ķ�Ӧ����Ϊ������Ӧ��
(2)��Ӧ�����Ҵ���������Ӧ����Ӧ�Ļ�ѧ����ʽΪ: 2CH3CH2OH��O2![]() 2CH3CHO
2CH3CHO
��2H2O��
��Ӧ�����Ҵ����Ʒ������û���Ӧ����Ӧ�����Ҵ��ƺ���������Ӧ�Ļ�ѧ����ʽΪ2CH3CH2OH��2Na��2CH3CH2ONa��H2����
(3)����������������ȡ����Ӧ�����е������ȷ�Ӧ����һ�������HCl�����ɵ�һ���������������һ����Ӧ�������������顢��������ȣ�ͬʱÿһ����Ӧ�������HCl���ɼ�������ȡ����Ӧ��ȡ�����鷽���������ĸ���Ӧ�࣬���ﲻ�������Ҳ��ʵͣ�����ϩ��HCl��һ�������·����ӳɷ�Ӧ�����������飬�������﴿�������Ҳ��ʻ��ߣ��ʷ������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Т��ĸ������Ϊ0.5 L�ĺ����ܱ��������ڢ��а���ͬͶ�ϱ�(Z)����HCl��O2(���±�)���������������Ӧ4HCl(g)��O2(g)![]() 2Cl2(g)��2H2O(g)����H��HCl��ƽ��ת����(��)��Z���¶�(t)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
2Cl2(g)��2H2O(g)����H��HCl��ƽ��ת����(��)��Z���¶�(t)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
���� | ��ʼʱ | ||
t/�� | n(HCl)/mol | Z | |
�� | 300 | 0.25 | a |
�� | 300 | 0.25 | b |
�� | 300 | 0.25 | 4 |
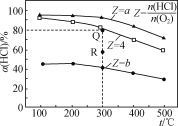
A. ��H<0��a<4<b
B. 300��÷�Ӧ��ƽ�ⳣ����ֵΪ64
C. ������ijʱ�̴���R�㣬��R�������>������ѹǿ��p(R)>p(Q)
D. ����ʼʱ�����������г���0.25molCl2��0.25molH2O(g)��300���ƽ��ʱ������c(HCl)��0.1mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����NOx��SO2���Ի�������������Ҫ�����塣�ش��������⣺
(1)SO2���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�SO2����֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£��� SO2(g) + NH3H2O(aq) =NH4HSO3(aq) ��H1 = a kJmol-1���� NH3H2O(aq) + NH4HSO3(aq) =(NH4)2SO3(aq) + H2O(l)��H2 = b kJmol-1���� 2(NH4)2SO3(aq) + O2(g) =2(NH4)2SO4(aq) ��H3= c kJmol-1����Ӧ 2SO2(g) + 4NH3H2O(aq) + O2(g) =2(NH4)2SO4(aq) + 2H2O(l) ��H = ______��
(2)NOx���ŷ���Ҫ����������β�����������÷�ӦC (s) + 2NO(g)![]() N2(g) + CO2(g) ��H����34.0 kJmol-1���û���̿��NO�����������ں�ѹ�ܱ������м��������Ļ���̿��һ������NO���壬���NO��ת���� ��(NO)���¶ȵı仯��ͼ��ʾ��
N2(g) + CO2(g) ��H����34.0 kJmol-1���û���̿��NO�����������ں�ѹ�ܱ������м��������Ļ���̿��һ������NO���壬���NO��ת���� ��(NO)���¶ȵı仯��ͼ��ʾ��
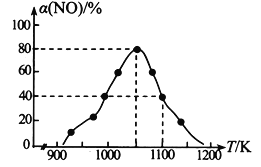
����ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����߶�����ԭ����_________________________�� ��1100K ʱ��CO2���������Ϊ______��
����ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��(����Kp������1050K��1.1��106Pa ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp��________(��֪�������ѹ��������ѹ���������)��
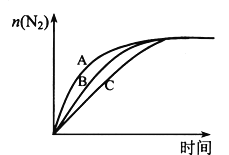
(3)�ڸ�Ч��������������CH4��ԭNO2��Ҳ�����������������Ⱦ������ͬ�����£�ѡ��A��B��C���ֲ�ͬ�������з�Ӧ������ N2�����ʵ�����ʱ��仯��ϵ��ͼ��ʾ�����л����С����_________(����ĸ���)��
(4)������β���ľ���װ���� CO��NO������Ӧ��2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) ��H2 =��746.8 kJmol-1��ʵ���ã�������k��c2(NO) c2(CO) ��������k��c(N2) c2(CO2) (k����k��Ϊ���ʳ�����ֻ���¶��йأ���
N2(g) + 2CO2(g) ��H2 =��746.8 kJmol-1��ʵ���ã�������k��c2(NO) c2(CO) ��������k��c(N2) c2(CO2) (k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٴﵽƽ��������¶ȣ�k������ı���_____(��" >������< ����=��) k������ı�����
������1L ���ܱ������г���1 mol CO��1 mol NO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ40%����![]() ��_____(����2λ��Ч����)��
��_____(����2λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���H ( )��һ�־�������ά���㷺���ڸ���ɲ��Ƭ����ϳ�·�����£�
)��һ�־�������ά���㷺���ڸ���ɲ��Ƭ����ϳ�·�����£�

��֪����C��D��G��Ϊ�����廯��������о�ֻ�����ֲ�ͬ��ѧ��������ԭ�ӡ�
��Diels-Alder��Ӧ��![]() ��
��
��1������A�ķ�Ӧ������_______��D��������_______��F�����������ŵ�������_______��
��2��B�Ľṹ��ʽ��_______����B��C���ķ�Ӧ�У���C�⣬����һ�ֲ�����_______��
��3��D+G��H�Ļ�ѧ����ʽ��______��
��4��Q��D��ͬϵ���Է���������D��14����Q���ܵĽṹ��______�֣����к˴Ź���������4��壬�ҷ������Ϊ1:2:2:3�Ľṹ��ʽΪ______����дһ�֣���
��5����֪����Ȳ��1,3-����ϩҲ�ܷ���Diels-Alder��Ӧ������1,3-����ϩ����ȲΪԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ� ��д���ϳ�·��__________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
��д���ϳ�·��__________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±��ش�������������Ϊ�����µ���������
�� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) |
CH3COOH | 1.8��10-5 | H2CO3 | K1=4.4��10-7 K2=4.7��10-11 | H2C2O 4 | K1=5.4��10-2 K2=5.4��10-5 | H2S | K1=1.3��10-7 K2=7.1��10-15 |
HClO | 3��10-8 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO-��HCO3-��CO32-��HC2O4-��ClO-��S2-�н��H+��������������__________��
��2��������0.1 molL-1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_______�����������
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
��3��0.1 molL-1��H2C2O4��Һ��0.1 molL-1��KOH����Һ�������Ϻ�������Һ�����ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________��
��4��pH��ͬ��NaClO��CH3COOK��Һ������Һ�����ʵ���Ũ�ȵĴ�С��ϵ�ǣ�CH3COONa______NaClO������Һ�У�[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)]���������������=������
��5����0.1 molL-1CH3COOH ��Һ�еμ� NaOH ��Һ�� c(CH3COOH): c(CH3COO-)=5 : 9����ʱ��ҺpH=_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������(����)

A. ͼ1��ʾ1 L pH��2��CH3COOH��Һ��ˮϡ����V L��pH��lg V�ı仯
B. ͼ2��ʾ��ͬ�¶���ˮ��Һ��H����OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2>T1
C. ͼ3��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ�������(N2����ʼ���㶨)�ı仯��ͼ��a��N2��ת����С��b��
D. ͼ4��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2BaO2(s) ![]() 2BaO(s)��O2(g)��O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
2BaO(s)��O2(g)��O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�m A(g)+n B(g) ![]() p C(g)��Ӧ��ƽ��ʱ����� c(A)Ϊ 0.5molL1���¶Ȳ��������£��������������һ�������ﵽ�µ�ƽ��ʱ����� c(A)Ϊ 0.3molL1���������ж�����ȷ����
p C(g)��Ӧ��ƽ��ʱ����� c(A)Ϊ 0.5molL1���¶Ȳ��������£��������������һ�������ﵽ�µ�ƽ��ʱ����� c(A)Ϊ 0.3molL1���������ж�����ȷ����
A. ƽ��������Ӧ�����ƶ� B. ����B��ת���ʼ�С
C. m + n <p D. ����C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����й����Ŀ�����Ӧ��ǰ��������Pt/Al2O3��Pd/C�� Rh/SiO2�����������������·�Ӧ���ϳɼ״�:2H2 (g)+CO(g)CH3OH(g)
(1)�±����������Ǹ���ѧ���ļ��ܣ��÷�Ӧ����H=_______(�ú���ĸ�Ĵ���ʽ��ʾ)��
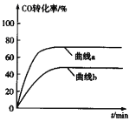
(2)ij����С����Pd/C����������450��ʱ���о���n(H):n(CO)�ֱ�Ϊ2:1��3:1ʱCOת���ʵı仯���(��ͼ)����ͼ�б�ʾn(H2)��n(CO)=3:1�ı仯����Ϊ______(��������a"��������b��)��
(3)ij��ѧ�о���ѧϰС��ģ�ҵ�ϳɼ״��ķ�Ӧ����2L�ĺ����ܱ������ڳ���1 mol CO��2molH2��������ʴ�������ij�¶��¿�ʼ��Ӧ������ѹ���Ƽ��������ѹǿ�ı仯���£�
��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 |
ѹǿ/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
��ӷ�Ӧ��ʼ��20minʱ��CO��ƽ����Ӧ����Ϊ________,���¶��µ�ƽ�ⳣ��KΪ_______.
(4)��CO��H2�����ܱ������У���һ�������·�����Ӧ��CO(g)+2H2(g) CH3OH(g) ��H<0��ƽ��ʱCO���������(%)���¶Ⱥ�ѹǿ�Ĺ�ϵ����ͼ��ʾ(���߿��ʾû�вⶨ�������µ�����)��
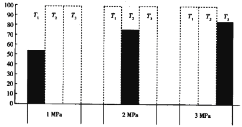
T1��T2��T3�ɴ�С�Ĺ�ϵ��_________,�ж�������____________
(5)���������ҹ�˾���������˶��״�ֱ��ȼ�ϵ�أ��乤��ԭ����ͼ
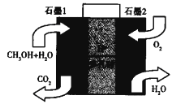
��ʯī2Ϊ__________ (����������������)����
��ʯī1�������ĵ缫��ӦʽΪ________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������100 mL0.020mol/L KMnO4��Һ�Ĺ�������ͼ��ʾ��
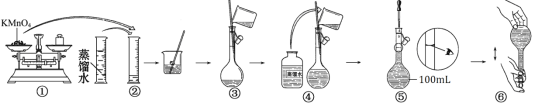
�ش��������⣺
��1��ͼʾ����������������ȷ��������_____��_____ ������ţ���
��2��������ͼʾ�е����������ֱ���________�� __________�������ƣ���
��3�������ͼʾ�IJ���������Һ�������Ƶ���ҺŨ�Ƚ�_______������ƫ��������ƫС������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com