
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。

① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
【答案】尿素 8Cl2 + 16OH- = 5ClO-+ ClO3- + 10Cl- + 8H2O 冰水浴冷却 通过冷凝回流,减少水合肼的挥发,提高水合肼的产率 NaClO碱性溶液 打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下 NaClO + CO(NH2)2 +2NaOH= NaCl + N2H4 ·H2O + Na2CO3 4 10
【解析】
由实验流程可知,氯气和氢氧化钠溶液的反应生成NaClO,为避免生成NaClO3,应控制温度在40℃以下,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3,结合对应物质的性质以及题给信息分析解答。
⑴根据流程图,本流程所用的主要有机原料为尿素,故答案为:尿素;
(2)若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,同时还生成NaCl,根据得失电子守恒,ClO-∶ClO3- ∶Cl- 物质的量之比为5∶1∶10,反应的离子方程式为8Cl2 + 16OH- = 5ClO-+ ClO3- + 10Cl- + 8H2O,故答案为:8Cl2 + 16OH- = 5ClO-+ ClO3- + 10Cl- + 8H2O;
⑶氯气与烧碱溶液的反应是放热反应,实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,避免反应过于剧烈,放出大量的热而导致温度升高,还可以用冰水浴冷却,故答案为:冰水浴冷却;
(4)①为避免N2H4H2O的挥发,使用冷凝管,起到冷凝回流,减少水合肼的挥发,提高水合肼的产率,故答案为:通过冷凝回流,减少水合肼的挥发,提高水合肼的产率;
②为了避免N2H4H2O与 NaClO剧烈反应生成N2,实验中通过滴液漏斗滴加的溶液是NaClO碱性溶液;将滴液漏斗内的液体放入三颈烧瓶内的操作是打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下,故答案为:NaClO碱性溶液;打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下;
③ 根据流程图,NaClO 和CO(NH2)2 在NaOH溶液中反应生成水合肼和碳酸钠,反应的化学方程式为NaClO + CO(NH2)2 +2NaOH= NaCl + N2H4 ·H2O + Na2CO3,故答案为:NaClO + CO(NH2)2 +2NaOH= NaCl + N2H4 ·H2O + Na2CO3;
(5)用Na2CO3制备无水Na2SO3,在Na2CO3溶液中通入过量的二氧化硫生成NaHSO3,然后在NaHSO3溶液中加入NaOH溶液可生成Na2SO3。
①由图像可知,溶液pH约为4时,可完全反应生成NaHSO3,此时可停止通入二氧化硫,故答案为:4;
②由图像可知pH约为10时,可完全反应生成Na2SO3,故答案为:10。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
A. X为0.2 mol·L-1
B. Y为0.1 mol·L-1
C. Z为0.3 mol·L-1
D. Z为0.1 mol·L-1时,Y为0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:

(1)该反应的化学方程式是________________________。
(2)反应起始至t,Y的平均反应速率是__________________。
(3)X的转化率是_________________。
(4)关于该反应的说法正确的是________。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用磷肥副产物氟硅酸钠(Na2SiF6)为原料合成冰晶石(Na3AlF6)成为一条合理利用资源、提高经济效益的新方法。工艺流程如下图所示:
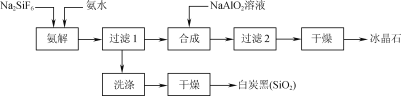
(1)传统合成冰晶石的方法是萤石(CaF2)法:使用萤石、石英和纯碱在高温下煅烧生成NaF,在NaF溶液中加入Al2(SO4)3溶液制得。在加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,
否则可能产生副产物____(填物质的化学式),但酸度不宜过强的原因是____。
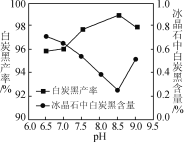
(2)氨解时白炭黑产率和冰晶石纯度与pH的关系如图,氨解时需要控制溶液的pH=____;能提高氨解速率的措施有____(填字母)。
A.快速搅拌
B.加热混合液至100℃
C.减小氨水浓度
(3)工艺流程中氨解反应的化学方程式为____;冰晶石合成反应的离子方程式为______。
(4)为了提高原料利用率,减少环境污染,可采取的措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验方案不能达到实验目的的是( )

A. 图A装置——Cu和稀硝酸制取NOB. 图B装置——检验乙炔的还原性
C. 图C装置——实验室制取溴苯D. 图D装置——实验室分离CO和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com