
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为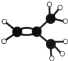 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。
【答案】P Ar ![]() 8 H++OH-=H2O 2KBr+Cl2=2KCl+Br2
8 H++OH-=H2O 2KBr+Cl2=2KCl+Br2
【解析】
根据元素周期表,可确定①为C元素、②为F元素、③为Mg元素、④为Al、⑤为P元素、⑥为S元素、⑦为Cl元素、⑧为Ar元素、⑨为K元素、⑩为Br元素,据此分析解答。
(1)根据分析,⑤为P元素,⑧为Ar元素;
(2) ①为C元素,最高价氧化物为CO2,其电子式是![]() ,烃A分子的球棍模型为
,烃A分子的球棍模型为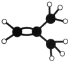 ,分子中含有碳碳双键,与碳碳双键直接相连的所有原子在同一平面,甲基上的氢原子最多只有一个与碳原子共面,则A分子中最多有8个原子共平面;
,分子中含有碳碳双键,与碳碳双键直接相连的所有原子在同一平面,甲基上的氢原子最多只有一个与碳原子共面,则A分子中最多有8个原子共平面;
(3)⑦为Cl元素,⑨为K元素,Cl元素最高价氧化物的水化物为HClO4,K元素最高价氧化物对应水化物为KOH,反应的离子方程式为:H++OH-=H2O;
(4)⑦为Cl元素,⑩为Br元素,氧化性强的可将氧化性弱的从其盐溶液中置换出单质,方程式为:2KBr+Cl2=2KCl+Br2。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】茉莉酸甲酯的一种合成路线如下:
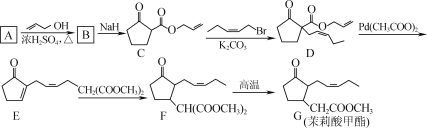
(1) C中含氧官能团名称为________。
(2) D→E的反应类型为________。
(3) 已知A、B的分子式依次为C6H10O4、C12H18O4,A中不含甲基,写出B的结构简式:________。
(4) D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①分子中含有苯环,能与FeCl3溶液发生显色反应;
②碱性条件水解生成两种产物,酸化后两种分子中均只有3种不同化学环境的氢。
(5) 写出以 和CH2(COOCH3)2为原料制备
和CH2(COOCH3)2为原料制备 的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
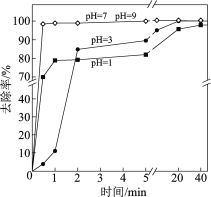
【题目】水体砷污染已成为一个亟待解决的全球性环境问题,我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的正五价砷[As(Ⅴ)],其机制模型如下。
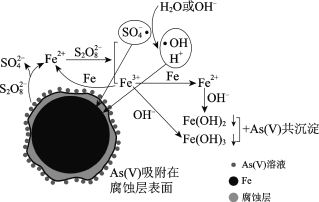
零价铁活化过硫酸钠去除废水中As(Ⅴ)的机制模型
资料:
Ⅰ.酸性条件下SO4·为主要的自由基,中性及弱碱性条件下SO4·和·OH同时存在,强碱性条件下·OH为主要的自由基。
Ⅱ.Fe2+、Fe3+形成氢氧化物沉淀的pH
离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe2+ | 7.04 | 9.08 |
Fe3+ | 1.87 | 3.27 |
(1)砷与磷在元素周期表中位于同一主族,其原子比磷多一个电子层。
① 砷在元素周期表中的位置是______。
② 砷酸的化学式是______,其酸性比H3PO4______(填“强”或“弱”)。
(2)零价铁与过硫酸钠反应,可持续释放Fe2+,Fe2+与S2O82反应生成Fe3+和自由基,自由基具有强氧化性,利于形成Fe2+和Fe3+,以确保As(Ⅴ)去除完全。
①S2O82中S的化合价是______。
②零价铁与过硫酸钠反应的离子方程式是______。
③Fe3+转化为Fe2+的离子方程式是______。
(3)不同pH对As(Ⅴ)去除率的影响如图。5 min内pH = 7和pH = 9时去除率高的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中有如下反应:2SO2(g)+O2 (g)![]() 2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是
2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是
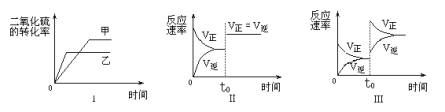
①图Ⅰ研究的是温度对化学平衡的影响,且乙的温度较高
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
④图Ⅲ研究的是t0时刻增大O2的浓度对反应速率的影响
A. ①②B. ②③C. ②④D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、VA及Ⅷ族元素是组成特殊材料的重要元素。
回答下列问题:
(1)基态硼核外电子占据的最高能级的电子云轮廓图形状为____。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___。
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为____。
(3)NH3能与众多过渡元素离子形成配合物,向CuSO4溶液中加入过量氨水,得到深蓝色溶液,向其中加人乙醇析出深蓝色晶体,加入乙醇的作用____,该晶体的化学式为_____。
(4)铜与(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为_____,HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是_______。
(5)MgCO3的热分解温度_____(填“高于”或“低于”)CaCO3的原因是________。
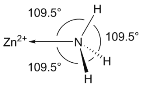
(6)NH3分子在独立存在时H-N-H键角为107°。如图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释NH3形成如图配合物后H-N-H键角变大的原因:_________。
(7)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为_____(用最简整数比表示)。假设晶胞边长为anm,NA代表阿伏伽德罗常数的值,则该晶胞的密度为________g/cm3。(用含a,NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z在周期表中的位置如图所示,下列说法错误的是( )
![]()
A. 简单氢化物沸点:X>Z
B. 用pH试纸可测得YZX和YZX4溶液分别显碱性和中性
C. W的单质可用于工业冶炼铁、硅
D. 原子半径:Y>W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液可能含有Na+、Cl-、CO32-、SO42-、Mg2+、NH4+中的几种,进行如下实验:将上述溶液分为两等份,其中一份滴加足量的BaCl2溶液,得到白色沉淀4.66g;另一份溶液中滴加足量的NaOH溶液,得到0.58g白色沉淀,加热后产生标准状况下的气体0.224L,该气体能使湿润的红色石蕊试纸变蓝色。下列说法正确的是( )
A.溶液中可能有Na+、Cl-
B.溶液中一定没有Cl-、CO32-
C.溶液中一定有Na+、SO42-、Mg2+、NH4+
D.溶液中是否存在Na+只能用焰色反应确认
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利多卡因盐酸盐(F)是一种酰胺类局麻药,对中枢神经系统有明显的兴奋和抑制双相作用,其合成路线如下图所示,请回答相关问题。
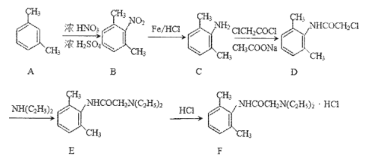
(1)A的系统名称是_____,D中的官能团名称是___。
(2)F的化学式是_____。
(3)B—C、D—E的反应类型依次是_____、_____。
(4)D与足量NaOH溶液加热充分反应的方程式是_____。
(5)G物质是比B多一个碳原子的同系物,符合下列要求的G的同系物有___种(不考虑立体异构),其中核磁共振氢谱有六组峰且面积比为3:2:2:2:1:1的结构简式是____(任写一种)。______
I.苯环上有两个取代基且其中一个不含碳原子 II.含有一COO—结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。

① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com