
【题目】利多卡因盐酸盐(F)是一种酰胺类局麻药,对中枢神经系统有明显的兴奋和抑制双相作用,其合成路线如下图所示,请回答相关问题。
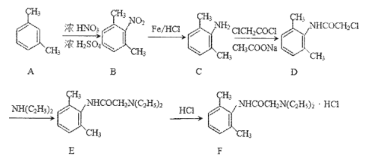
(1)A的系统名称是_____,D中的官能团名称是___。
(2)F的化学式是_____。
(3)B—C、D—E的反应类型依次是_____、_____。
(4)D与足量NaOH溶液加热充分反应的方程式是_____。
(5)G物质是比B多一个碳原子的同系物,符合下列要求的G的同系物有___种(不考虑立体异构),其中核磁共振氢谱有六组峰且面积比为3:2:2:2:1:1的结构简式是____(任写一种)。______
I.苯环上有两个取代基且其中一个不含碳原子 II.含有一COO—结构
【答案】1,3-二甲苯 肽键、氯原子 C14H23N2OCl 还原反应 取代反应  24
24 ![]()
【解析】
(1)A为![]() ,系统名称是1,3-二甲苯,D为
,系统名称是1,3-二甲苯,D为![]() ,官能团名称是肽键、氯原子;
,官能团名称是肽键、氯原子;
(2)F为![]() ,根据结构简式可知,其化学式是C14H23N2OCl;
,根据结构简式可知,其化学式是C14H23N2OCl;
(3)B—C是![]() 是在铁和氯化氢作用下发生还原反应生成
是在铁和氯化氢作用下发生还原反应生成![]() ,属于还原反应;D—E是
,属于还原反应;D—E是![]() 与NH(C2H5)2发生取代反应生成
与NH(C2H5)2发生取代反应生成![]() 和HCl,反应类型是取代反应;
和HCl,反应类型是取代反应;
(4)D为![]() ,与足量NaOH溶液加热充分反应生成
,与足量NaOH溶液加热充分反应生成![]() 、氯化钠、HOCH2COONa的方程式是
、氯化钠、HOCH2COONa的方程式是 ;
;
(5)G的分子式是,其中一个取代基是氨基,另一个取代基含三个碳且有酯基或羧基,共8种:-CH2CH2COOH、-CH(CH3)COOH、-OOCC2H5、-CH2OOCCH3、-CH2CH2OOCH、-CH(CH3)OOCH、-COOC2H5、-CH2COOCH3。两个取代基的位置有邻位、间位、对位,因此符合要求的同分异构体共有24种。


科目:高中化学 来源: 题型:
【题目】以下为氨气部分用途

下列有关叙述错误的是
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为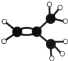 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g)![]() CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度b.加入催化剂 c.减小CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
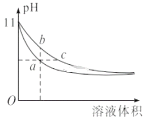
A. a点导电能力比b点强
B. a、c两点的c(H+)相等
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. b点的Kw值大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1molH—H键断裂的同时断裂2molH—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
2Z(g),若X、Y、Z的起始浓度分别为0.1 mol·L-1、0.3mol·L-1和0.2mol·L-1,则平衡时各物质的浓度不可能是( )
A. X为0.2 mol·L-1
B. Y为0.1 mol·L-1
C. Z为0.3 mol·L-1
D. Z为0.1 mol·L-1时,Y为0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用磷肥副产物氟硅酸钠(Na2SiF6)为原料合成冰晶石(Na3AlF6)成为一条合理利用资源、提高经济效益的新方法。工艺流程如下图所示:
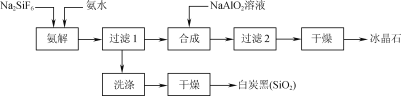
(1)传统合成冰晶石的方法是萤石(CaF2)法:使用萤石、石英和纯碱在高温下煅烧生成NaF,在NaF溶液中加入Al2(SO4)3溶液制得。在加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,
否则可能产生副产物____(填物质的化学式),但酸度不宜过强的原因是____。
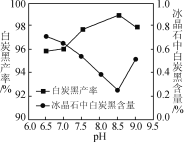
(2)氨解时白炭黑产率和冰晶石纯度与pH的关系如图,氨解时需要控制溶液的pH=____;能提高氨解速率的措施有____(填字母)。
A.快速搅拌
B.加热混合液至100℃
C.减小氨水浓度
(3)工艺流程中氨解反应的化学方程式为____;冰晶石合成反应的离子方程式为______。
(4)为了提高原料利用率,减少环境污染,可采取的措施是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com