
【题目】在容积不变的密闭容器中有如下反应:2SO2(g)+O2 (g)![]() 2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是
2 SO3(g);△H<0。某研究小组进行了当其他条件不变时,改变某一条件对上述反应影响的研究,下列分析正确的是
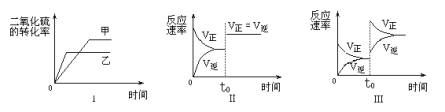
①图Ⅰ研究的是温度对化学平衡的影响,且乙的温度较高
②图Ⅱ研究的是催化剂对反应速率的影响,化学平衡不移动
③图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
④图Ⅲ研究的是t0时刻增大O2的浓度对反应速率的影响
A. ①②B. ②③C. ②④D. ③④
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】NVCO{化学式可表示为(NH4)a[(VO)b(CO3)c(OH)d]·10H2O}能用于制取VO2,实验室可由V2O5、N2H4·2HCl、NH4HCO3为原料制备NVCO。
(1)原料NH4HCO3中HCO3-水解的离子方程式为____________。
(2) N2H4·2HCl是N2H4的盐酸盐。已知N2H4在水中的电离方式与NH3相似,25 ℃时,K1=9.55×10-7。该温度下,反应N2H4+H+![]() N2H5+的平衡常数K=________(填数值)。
N2H5+的平衡常数K=________(填数值)。
(3)为确定NVCO的组成,进行如下实验:
①称取2.130 g样品与足量NaOH充分反应,生成NH3 0.224 L(已换算成标准状况下)。
②另取一定量样品在氮气氛中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示(分解过程中各元素的化合价不变)。
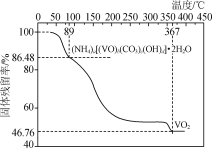
根据以上实验数据计算确定NVCO的化学式(写出计算过程)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为氨气部分用途

下列有关叙述错误的是
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、Cr3+对环境具有极强的污染性,含有
、Cr3+对环境具有极强的污染性,含有![]() 、Cr3+的工业废水常采用NaOH沉淀方法除去。
、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成![]() :Cr3++3OH
:Cr3++3OH![]() Cr(OH)3
Cr(OH)3![]()
![]() +H++H2O。②
+H++H2O。②![]() 还原产物为Cr3+。③lg3.3=0.50。
还原产物为Cr3+。③lg3.3=0.50。
请回答下列问题:
(1)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___________。
(2)常温下,向50 mL 0.05 mol·L1的Cr2(SO4)3溶液中加入1.0 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为______。
(3)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定管装液前的操作是_______。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(4)根据2![]() +2H+
+2H+![]()
![]() +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应为_______________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应为_______________。
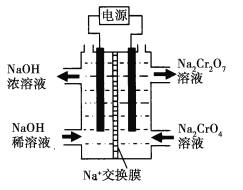
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求书写出方程式。
(1)NO2与水形成酸雨的化学方程式为______________________________。
(2)1754年,Briestly用硵砂(主要成份NH4Cl)和熟石灰共热制得了氨,化学反应方程式为______________________________。
(3)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程_________________________________。
(4)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)⑤和⑧的元素符号是_______和_______。
(2)元素①的最高价氧化物的电子式是_________________,元素①的某种烃A分子的球棍模型为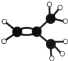 ,则A分子中最多有______个原子共平面。
,则A分子中最多有______个原子共平面。
(3)元素⑦和⑨的最高价氧化物的水化物反应的离子方程式为:____________________。
(4)请用化学方程式表示比较⑦、⑩单质氧化性的强弱:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g)![]() CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度b.加入催化剂 c.减小CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com