
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
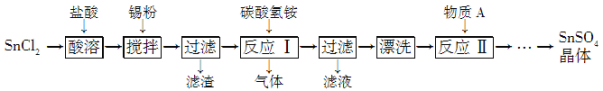
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡 Sn(OH)Cl]。
(1) 写出物质A的名称:___ _____。
(2) SnCl2用盐酸而不用水溶解的原因是__________ __________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:
_______________ _______________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:_ _ __。该反应的温度需要控制在75 ℃左右的原因是_ _ _ _。
(5) 实验室中“漂洗”沉淀的实验操作方法是_ _ __。
【答案】(1) 硫酸(或硫酸溶液或稀硫酸)
(2) SnCl2+H2O![]() Sn(OH)Cl+HCl(不写可逆符号的也给分)
Sn(OH)Cl+HCl(不写可逆符号的也给分)
(3) 2Sn2++O2+4H+===2Sn4++2H2O
(4) SnCl2+2NH4HCO3===SnO↓+2CO2↑+2NH4Cl+H2O
温度较低时反应速率小,温度较高时碳酸氢铵会分解(其他合理答案均可)
(5) (沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次
【解析】
试题分析:(1)流程中前部分是溶解除杂过程,生成碳酸锡(反应1)再加硫酸溶解得到硫酸锡;
(2)SnCl2能水解,用盐酸溶解为了抑制其水解,水解反应式为SnCl2+H2O![]() Sn(OH)Cl+HCl;
Sn(OH)Cl+HCl;
(3)信息中提出在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+,被氧化的反应过程为2Sn2++O2+4H+===2Sn4++2H2O;
(4)生成SnO的化学方程式为SnCl2+2NH4HCO3===SnO↓+2CO2↑+2NH4Cl+H2O;温度控制在75 ℃左右有两个方面的原因,温度低反应速率低产量小,温度高反应物碳酸氢铵易分解;
(5)“漂洗”沉淀就是洗涤沉淀,需要直接在过滤器中进行,(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是谁处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
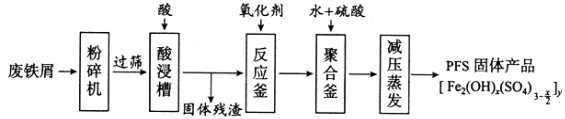
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
A.KMnO4 B.![]() C.
C.![]() D.
D.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________
,已知该样品中Fe的质量分数w,则B的表达式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一的黑火药,它的爆炸反应为:
2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ;含极性共价键的分子的中心原子轨道杂化类型为___________________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等。下列有关说法正确的是
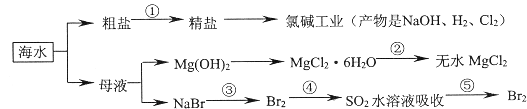
A.以NaCl为工业原料可以生产烧碱、纯碱以及漂白粉等含氯产品
B.工业上通过电解饱和MgCl2溶液制取金属镁
C.第③④⑤步的目的是浓缩、富集溴单质,这三步中溴元素均被氧化
D.过程①除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) ![]() x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
A. 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B. 平衡时,甲、乙两容器中A、B的物质的量之比相等
C. 平衡时,甲中A的体积分数为40%
D. 若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeCl3、Al2(SO4)3的混合溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断正确的是
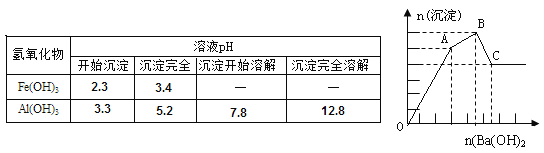
A.AB段可能发生的反应是:2SO42-+2Ba2++Al3++3OH-=2BaSO4↓+Al(OH)3↓
B.C点的沉淀为Fe(OH)3
C.OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Fe3++Al3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中c(Cl-)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为 。
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为 。
Ⅱ.配位浸出
反应原理为:![]()
(2)为提高黄铜矿的浸出率,可采取的措施有 (至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4C1,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向amol·L-l的氨水中缓慢加入等体积0.02 mol·L-l的NH4C1溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb= (用含a的代数式表示);滴加NH4C1溶液的过程中水的电离平衡 (填“正向”、“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
(4)在微生物的作用下,可以循环使用的物质有 (填化学式),微生物参与的离子反应方程式为____ (任写一个)。

(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醇和乙酸的说法错误的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.相同条件下,与金属钠反应的速率,乙醇比乙酸慢
C.乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得
D.乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对能量转化的认知中,不正确的是( )
A.电解水生成H2和O2时,电能主要转化为化学能
B.风力发电时,风能主要转化为电能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,电能全部转化为光能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com