
【题目】在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g) ![]() x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
x C(g)+D(s)。向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B、3 mol C和2 mol D,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%。下列叙述中不正确的是
A. 若平衡时,甲、乙两容器中A的物质的量不相等,则x=4
B. 平衡时,甲、乙两容器中A、B的物质的量之比相等
C. 平衡时,甲中A的体积分数为40%
D. 若平衡时两容器中的压强不相等,则两容器中压强之比为8∶5
【答案】C
【解析】本题考查化学反应平衡。在一定温度条件下,甲、乙两个容积相等的恒容密闭容器中均发生如下反应:3A(g)+B(g)![]() xC(g) + D(s),向甲中通入6molA和2 molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%,若平衡时,甲、乙两容器中A的物质的量不相等,则x=4,A不正确;平衡时,甲、乙两容器中A、B的物质的量之比相等(初始投入量和转化量均满足化学计量数之比),B不正确;此时测得甲、乙两容器中C的体积分数都为20%,平衡时A、B物质的量之比为3:1,则平衡时甲中A的体积分数为60%,C正确;若平衡时两容器中的压强不相等,则x=4,反应前后气体体积无变化,因此压强之比等于气体物质的量之比。
xC(g) + D(s),向甲中通入6molA和2 molB,向乙中通入1.5molA、0.5molB、3molC和2molD,反应一段时间后都达到平衡,此时测得甲、乙两容器中C的体积分数都为20%,若平衡时,甲、乙两容器中A的物质的量不相等,则x=4,A不正确;平衡时,甲、乙两容器中A、B的物质的量之比相等(初始投入量和转化量均满足化学计量数之比),B不正确;此时测得甲、乙两容器中C的体积分数都为20%,平衡时A、B物质的量之比为3:1,则平衡时甲中A的体积分数为60%,C正确;若平衡时两容器中的压强不相等,则x=4,反应前后气体体积无变化,因此压强之比等于气体物质的量之比。
甲中
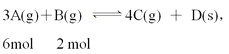
乙中
通入1.5molA、0.5molB、3molC和2molD,
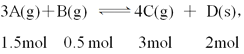
P甲/P乙=(6+2)/(1.5+0.5+3)=8/5,D不正确。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】Al及Al的合金在生活生产中有着广泛的应用
(1)航母升降机可由铝合金制造。
①Al元素在周期表中的位置是 ;
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为: 。
(2)2015年11月首架C919大飞机总装下线,标志着我国跻身飞机研制先进国家行列。机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂合金性质的是 (填字母)。
a.密度大 b.硬度大 c.抗腐蚀
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO![]() 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。
利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为__ __。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。
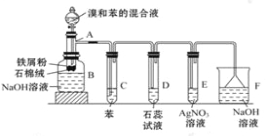
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式: _________________ _____。
(2)试管C中苯的作用是_________。反应开始后,观察D和E两试管,看到的现象为_________。
(3)反应2 min~3 min后,在B中的NaOH溶液里可观察到的现象是_______________。
(4)在上述整套装置中,具有防倒吸作用的仪器有_____ ___(填字母)。
(5)该实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是_____ _ _ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验。
(1)称取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为b L,反应的离子方程式为 。
(2)称取同样的a g样品,在高温下恰好完全反应。
(3)待(2)中反应产物冷却后,加入足量盐酸,测得生成的气体体积为c L,该气体与(1)中所得气体的体积比,c:b为_______________。
根据上述实验可确定该铝热剂中含Al的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
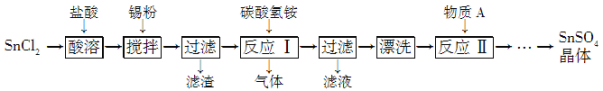
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡 Sn(OH)Cl]。
(1) 写出物质A的名称:___ _____。
(2) SnCl2用盐酸而不用水溶解的原因是__________ __________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:
_______________ _______________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:_ _ __。该反应的温度需要控制在75 ℃左右的原因是_ _ _ _。
(5) 实验室中“漂洗”沉淀的实验操作方法是_ _ __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物 B.若生成4.48 L HF,则转移0.8 mol电子
C.O2F2既是氧化剂又是还原剂 D.还原剂与氧化剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除金、铂等极少数金属外,绝大多数金属元素以化合物形式存在于自然界中,将金属元素从其化合物中还原出来的工业工程称为金属的冶炼。下列材料描述了一些常见金属的冶炼方法。
①工业上冶炼镁的方法有两种,电解法和皮江法。电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁。
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气。
③湿法炼铜是工业上常用的一种炼铜的方法。使用铁和硫酸铜溶液反应。
④工业上冶炼银的方法是加热条件下让氧化银分解。
⑤冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰。
⑥相关各物质熔点见下表:
物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
Ⅰ根据上述信息回答下列问题:
(1)影响金属冶炼方法的首要因素是 。
(2)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是 。
(3)写出铝热法冶炼锰的化学方程式 ,一般使用铝热法冶炼的金属具有哪些性质 。
Ⅱ下面是皮江法冶炼镁的工业流程示意图
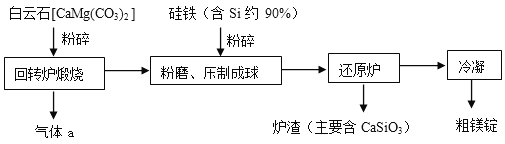
(1)气体a是 。
(2)白云石煅烧前粉碎的目的是 。
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空。还原炉中发生的主要反应有 、 。
(4)还原炉中抽空气到近似真空的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________方法区别晶体、准晶体和非晶体。
(2)基态Fe原子有_________个未成对电子,Fe3+的电子排布式为 _。可用硫氰化钾检验Fe3+,现象是 。
(3)根据价层电子对互斥理论判断:SO42—的立体构型为_ ,H3O+ 的立体构型为 。
(4)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道为___________,1mol乙醛分子中含有的![]() 键的数目为___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
键的数目为___________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
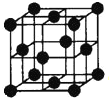
(5)Al单质为面心立方晶体,其晶胞如图。晶胞中铝原子的配位数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com