
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是谁处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
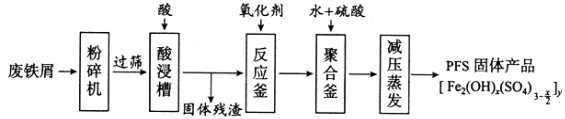
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
A.KMnO4 B.![]() C.
C.![]() D.
D.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________
,已知该样品中Fe的质量分数w,则B的表达式为__________
【答案】(1)Fe2O3·xH2O;选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率 ;(2)硫酸Fe2O3·xH2O+6H+=2Fe3++3SO42-+(x+3)H2O;(3)氧化Fe2+ ,c ;(4)pH过大,容易生成Fe(OH)3,产率降低;(5)减压蒸馏,可防止温度过高,聚合硫酸铁分解 ;(6)![]() 。
。
【解析】
试题分析:(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为Fe2O3·xH2O 。粉碎过筛的目的是控制铁屑的颗粒。
(2)由于不能引入杂质,则酸浸时最合适的酸是硫酸,铁锈与酸反应的离子方程式为Fe2O3·xH2O+6H+=2Fe3++3SO42-+(x+3)H2O。
(3)由于溶液中含有亚铁离子,则反应釜中加入氧化剂的作用是氧化Fe2+,由于不能引入杂质,则氧化剂中最合适的是绿色氧化剂双氧水。
(4)聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时![]() 水解程度弱,pH偏大时则Fe3+转化为氢氧化铁沉淀而损失,造成产率降低。
水解程度弱,pH偏大时则Fe3+转化为氢氧化铁沉淀而损失,造成产率降低。
(5)相对于常压蒸发,减压蒸发的优点是可防止温度过高,聚合硫酸铁分解。
(6)做空白对照试验,消耗NaOH溶液![]() ,说明与样品反应的盐酸的物质的量是(V0-V)c×10-3mol,所以样品中氢氧根的物质的量是(V0-V)c×10-3mol。已知该样品中Fe的质量分数w,则铁的物质的量是
,说明与样品反应的盐酸的物质的量是(V0-V)c×10-3mol,所以样品中氢氧根的物质的量是(V0-V)c×10-3mol。已知该样品中Fe的质量分数w,则铁的物质的量是![]() ,因此B的表达式为
,因此B的表达式为![]() =
=![]() 。
。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:
。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I、打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体;铁粉与水蒸气在高温下也可生成该黑色固体,
(1)反应的化学方程式为 。
(2)将该黑色固体溶于盐酸中,反应的离子反应方程式 。
II、某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:

请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl 2 +H 2 ↑外,其他可能反应的离子方程式为 。
(2)若将③该加H2O2 书写离子反应方程式 。
(3)若溶液B中只含有Fe 2+ 而不含Fe 3+ ,可证明该事实的实验方法是( )
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B、②③ C、③④ D、①④
(4)步骤④化学方程式为 。
(5)若除去氯化铜中氯化铁可以加入剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
A.A﹥B﹥E﹥D B.D﹥A﹥B﹥E C.D﹥E﹥A﹥B D.A﹥B﹥D﹥E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al及Al的合金在生活生产中有着广泛的应用
(1)航母升降机可由铝合金制造。
①Al元素在周期表中的位置是 ;
②Al—Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为: 。
(2)2015年11月首架C919大飞机总装下线,标志着我国跻身飞机研制先进国家行列。机身蒙皮使用的是第三代铝锂合金材料。下列不属于铝锂合金性质的是 (填字母)。
a.密度大 b.硬度大 c.抗腐蚀
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO![]() 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。
利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba
b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定
d.Ba的沸点比Al的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程。
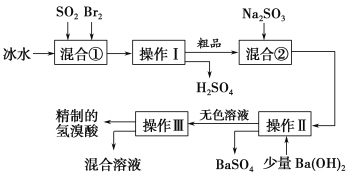
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为________________________________。
(2)混合①中使用冰水的目的是________________________________。
(3)操作Ⅱ和操作Ⅲ的名称分别是________、________。
(4)混合液②中加入Na2SO3的目的是_________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察的现象为___________。乙同学假设工业氢溴酸呈淡黄色是因为________________________,其用于证明该假设所用的试剂为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对事实的解释不正确的是
选项 | 事实 | 解释 |
A | 用铝罐槽车储运浓硫酸 | 常温下,铝与浓硫酸不反应 |
B | 在蔗糖中加入浓硫酸后出现发黑 | 浓硫酸具有脱水性 |
C | 浓硝酸在光照下颜色变黄 | 浓HNO3不稳定,生成的有色产物NO2能溶于浓硝酸 |
D | SO2能使溴水褪色 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列说法的判断正确的是
A. 漂白粉在空气中不稳定,可用于漂白纸张
B. 漂白粉中的CaCl2与空气中的CO2反应可生成CaCO3,漂白粉在空气中久置变质
C.NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验
D. 打磨磁石制指南针不涉及化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
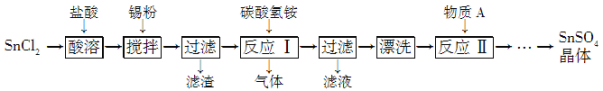
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡 Sn(OH)Cl]。
(1) 写出物质A的名称:___ _____。
(2) SnCl2用盐酸而不用水溶解的原因是__________ __________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:
_______________ _______________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:_ _ __。该反应的温度需要控制在75 ℃左右的原因是_ _ _ _。
(5) 实验室中“漂洗”沉淀的实验操作方法是_ _ __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com