
����Ŀ��ijʵ������Ҫ����500mL 0.10mol/L Na2CO3��Һ��

��1�����貣�������У����������ձ���100mL��Ͳ��________��________
��2��ʵ��ʱͼ����ʾ�������Ⱥ�˳��Ϊ________�����ţ�
��3�������ƹ����У����в�����������ҺŨ������Ӱ�죿������ƫ��������ƫ����������Ӱ������
�ٳ���ʱ����������������________ ��ת����Һ��û��ϴ���ձ��Ͳ�����________
��������ƿ��ˮ����ʱ����Һ��________ ��ҡ�Ⱥ�Һ���½����ټ�ˮ���̶���________
��4������Na2CO3���������Ϊ____g��������Ũ��Һϡ�ͣ���Ҫ��ȡ2mol/L Na2CO3��Һ________mL��
���𰸡���ͷ�ι� 500mL����ƿ �ڢܢۢݢ٢� ƫ�� ƫ�� ƫ�� ƫ�� 5.3 25.0
��������
ʵ������Ҫ����500mL 0.10mol/L Na2CO3��Һ��Ӧѡ��500mL����ƿ���������裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�
��1��ʵ������Ҫ����500mL 0.10mol/L Na2CO3��Һ��Ӧѡ��500mL����ƿ���������裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ��õ���������������ƽ��ҩ�ס��ձ�����������500mL����ƿ����ͷ�ιܣ����Ի�ȱ�ٵIJ�������Ϊ��500mL����ƿ����ͷ�ιܣ��ʴ�Ϊ��500mL����ƿ����ͷ�ιܣ�
��2������һ�����ʵ���Ũ����Һ��һ�㲽�裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ�������ȷ�IJ�������Ϊ���ڢܢۢݢ٢ޣ��ʴ�Ϊ���ڢܢۢݢ٢ޣ�
��3���ٳ���ʱ���á��������������������ƽԭ�������̵�����=���̵�����+���������������ʵ�ʳ�ȡ������=���������-�������������ȡ�����ʵ�����ƫС�����ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ��ʴ�Ϊ��ƫ�ͣ�
��ת����Һ��û��ϴ���ձ��Ͳ��������������ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ��ʴ�Ϊ��ƫ�ͣ�
��������ƿ��ˮ����ʱ����Һ�棬������Һ���ƫС����Һ�����ʵ���Ũ��ƫ�ߣ��ʴ�Ϊ��ƫ�ߣ�
��ҡ�Ⱥ�Һ���½����ټ�ˮ���̶��ߣ�������Һ���ƫ����ҺŨ��ƫ�ͣ��ʴ�Ϊ��ƫ�ͣ�
��4��ʵ������Ҫ����500mL 0.10mol/L Na2CO3��Һ��Ӧѡ��500mL����ƿ����Ҫ̼���Ƶ�����m=0.10mol/L��106g/mol��0.5L=5.3g��������Ũ��Һϡ�ͣ�����Ҫ��ȡ2mol/L Na2CO3��Һ���ΪV����������Һϡ�������������ʵ����ʵ��������V��2mol/L=0.10mol/L��500mL�����V=25.0mL���ʴ�Ϊ��5.3��25.0��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ��NaCl��MgCl2��AlCl3������Һ������Һ�����Ϊ3��2��1ʱ��������Һ��Cl�������ʵ���֮��Ϊ
A. 3��4��3B. 1��2��3C. 3��2��1D. 1��1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г�������֮���һЩ��Ӧ��ϵ�����в��ֲ���δд����������X�ǹ��壬B��G��Һ�壬�����Ϊ���塣������ͼ��ϵ�ƶϣ�

(1)д����ѧʽ��X_______��A________��B_______��
(2)ʵ�����ռ�����D��F�ķ���������_______����________����
(3)д��C��E�Ļ�ѧ����ʽ��____________��
(4)��д��A��E��Ӧ����D�Ļ�ѧ����ʽ��_______________
(5)��������A�ķ�����������________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ��ͨ���ѽ���Եõ���ϩ����ϩ�IJ���������������һ������ʯ�ͻ�����չˮƽ����ͼ������ϩΪԭ������ijЩ������Ʒ��ת����ϵͼ��

(1)��ϩ����B�ķ�Ӧ������_______________________��
(2)A��������_______________________________ ��
(3)C�к��еĹ������� _________________________(������)��
(4)д��B+D��E�Ļ�ѧ��Ӧ����ʽ��___________________________��
(5)д����Dͬ���E������ͬ���칹��Ľṹ��ʽ_____________��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������ӵ�ص��ܷ�ӦʽΪ2Li+FeS=Fe+Li2S��LiPF6��SO(CH3)2Ϊ����ʣ��øõ��Ϊ��Դ��⺬�����Է�ˮ���õ�����Ni��ʵ��װ����ͼ��ʾ������˵���������
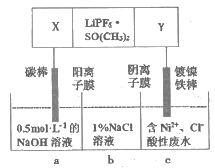
A. �缫YӦΪLi
B. X����ӦʽΪFeS+2Li++2e��=Fe+Li2S
C. �������У�b��NaCl��Һ�����ʵ���Ũ�Ƚ����ϼ�С
D. ����ͼ��������Ĥȥ������a��b���Һϲ������ⷴӦ�ܷ���ʽ�����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ���д���˳���칹�����( )
A. ��ϩ B. 1-��ϩ
C. 2-��-2-��ϩ D. 2-��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ǿ�ѧ����һֱ��̽�������⣬�����ڹ�ũҵ�������������������Ҫ�����á��ش��������⣺
I.��1����֪��������ת�������е������仯��ͼ(ͼ�б�ʾ����2 moI NO2�������仯)��1 moI NO����ΪNO2���ʱ��H=___________kJ/mol��
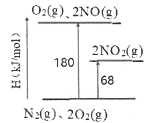
��2��ij�¶��£���Ӧ��ƽ�ⳣ�����£�
a.2NO2(g)![]() N2(g)+2O2(g) K=6.7��1016
N2(g)+2O2(g) K=6.7��1016
b.2NO(g)![]() N2(g)+O2(g) K=2.2��1030
N2(g)+O2(g) K=2.2��1030
�ֽⷴӦ���ƽϴ�ķ�Ӧ��___________(�a����b��)����Ӧ2NO(g)+O2(g)![]() 2NO2(g)��K=___________��
2NO2(g)��K=___________��
��3����֪��Ӧ2NO(g)+O2(g)![]() 2NO2(g)������Ӧ����v��=k1cm(NO)cn(O2)������kΪ���ʳ������÷�Ӧ������Ϊ��
2NO2(g)������Ӧ����v��=k1cm(NO)cn(O2)������kΪ���ʳ������÷�Ӧ������Ϊ��
��һ����NO+NO=N2O2 ����ƽ��
�ڶ�����N2O2+O2![]() 2NO2 ����Ӧ
2NO2 ����Ӧ
���пɽ�����Ϊ�ڶ�����Ӧ��Ӱ���һ����ƽ�⣬��һ����Ӧ�У�v(��)=k1c2(NO)����(��)=k��1c(N2O2)������������ȷ����___________(����ĸ)��
A.��һ����Ӧ��ƽ�ⳣ��K=![]()
B.v(��һ��������Ӧ)<v(�ڶ����ķ�Ӧ)
C.�ڶ����Ļ�ܱȵ�һ���Ļ�ܸ�
D.�ڶ�����N2O2��O2����ײ100%��Ч
II.�Ȱ�����������������Ӧ���ɵ�һ�����dz��õ�����ˮ��������������Ҫ����һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)����������������ˮ����������ҵ�Ͽ����÷�Ӧ2C12(g)+NH3(g)![]() NHCl2(l)+HCl(g)�Ʊ����Ȱ���
NHCl2(l)+HCl(g)�Ʊ����Ȱ���
��1�����Ȱ������ԡ����Ի����лᷢ��ǿ��ˮ�⣬���ɾ���ǿɱ�����õ����ʣ�д������ǿɱ�����õ����ʵĵ���ʽ______________________��
��2���ں��������£���2 mol Cl2��1 moI NH3����ij�ܱ������з���������Ӧ�����ƽ��ʱCl2��HC1�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ����A��B��C������Cl2ת������ߵ���___________��(�A����B����C��)������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=___________(Kp��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ���������)
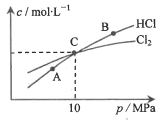
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£����һ�����ܱ������н������¿��淴Ӧ��3X(g)+2Y(s)![]() 2Z(g)+W(g) ��H>0�����������������
2Z(g)+W(g) ��H>0�����������������
A. �����¶ȣ����淴Ӧ���ʶ�����
B. ����λʱ����ÿ����3molX��ͬʱ����2molZ����Ӧ�ﵽ��ѧƽ��״̬
C. �ʵ�����ѹǿ����ѧƽ�ⲻ�����ƶ�
D. ƽ��ʱ��X��W�����ʵ���Ũ��֮��һ��Ϊ3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д������������ˮ�е���ķ���ʽ:
(1)����__________________________________��
(2)��������______________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com