
【题目】在压强为0.1MPa、10L恒容的密闭容器中,将2molCO与5molH2的混合气体在催化剂作用下能生成甲醇CO(g)+2H2(g)=CH3OH(g)△H<0请回答下列问题:
(1)该反应的熵变ΔS_________________0(填“>”、“<”或“=”).
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为_________________mol
②反应的平衡常数K=_________________;
③反应0-5min在区间的平均反应速率v(H2)=_________________
(3)向反应器中再分别充入下列气体,能使CO转化率增大的是_________________
A.CO B.H2 C.CH3OH D.He
【答案】< 4 75 0.06mol﹒L﹒min-1 B
【解析】
(1)根据气体的计算数进行判断;
(2)根据三行式,结合A转化率=![]() ×100%,平衡常数K=
×100%,平衡常数K=![]() ,反应速率=
,反应速率=
![]() 进行计算;
进行计算;
(3) 根据平衡移动原理进行分析。
(1)该反应中,反应物的系数和大于产物气体系数和,所以该反应是熵减的反应,熵变小于零,故ΔS<0;
(2)①若温度T2时,5min后反应达到平衡,CO的转化率为75%,则反应的CO的物质的量为:2mol×75%=1.5mol,反应的氢气的物质的量为:1.5mol×2=3mol,平衡时CO的物质的量为:2-1.5=0.5mol,氢气的物质的量为5-3=2mol,甲醇的物质的量为1.5mol,故平衡时体系总的物质的量为0.5+2+1.5=4mol;
②平衡时CO的物质的量为0.5mol,氢气的物质的量为2mol,甲醇的物质的量为1.5mol,则平衡常数K=![]() =
=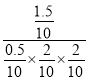 =75L2/mol2;
=75L2/mol2;
③反应的氢气的物质的量为3mol,故v(H2)=![]() =0.06 molL-1min-1;
=0.06 molL-1min-1;
(3) 反应CO(g)+2H2(g)=CH3OH(g) △H<0为气体体积减小的放热反应。
A. 向反应器中再充入CO,反应正向移动,但加入的量比转化的少得多,则CO的转化率反而减小,选项A不符合;
B. 向反应器中再充入H2 ,反应正向移动,CO的转化率增大,选项B符合;
C. 向反应器中再充入CH3OH,反应逆向移动,CO的转化率减小,选项C不符合;
D. 向反应器中再充入He,各反应物的浓度不变,平衡不移动,CO的转化率不变,选项D不符合;
答案选B。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】在某密闭容器中,发生如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
A.平衡体系增加O2对反应的影响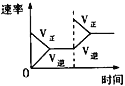
B.温度对反应的影响
C.压强对反应的影(P1>P2)
D.催化剂对反应的影响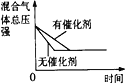
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
A.达到化学平衡时,4v正(O2)=5v正(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 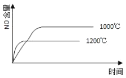
B. 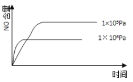
C. 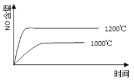
D. 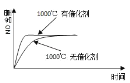
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠是一种重要的化工原料,在日常生活中也有广泛的用途,侯德榜先生发明了连续生产纯碱与氯化铵的联合制碱工艺,成为近代化学工业的奠基人之一,该反应原理为:![]() 饱和
饱和![]() .
.
现用如图所示装置和上述原理制取碳酸氢钠晶体,图中夹持装置已略去.
可选用的药品有:①石灰石②生石灰③![]() 盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液

请回答下列问题
(1)仪器a的名称是______.
(2)![]() 中应选用的药品是______
中应选用的药品是______![]() 填序号
填序号![]()
(3)在实验过程中,应先向C中通入的气体的化学式是______,其原因是______.
(4)![]() 中脱脂棉应浸润的试剂是______
中脱脂棉应浸润的试剂是______![]() 填写字母编号
填写字母编号![]()
![]() 浓硫酸
浓硫酸 ![]() 稀硫酸
稀硫酸 ![]() 氢氧化钠溶液
氢氧化钠溶液 ![]() 浓硝酸
浓硝酸
(5)该小组同学为了测定C中所得晶体中碳酸氢钠的纯度![]() 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质![]() ,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:
,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:

![]() 操作Ⅲ中的方法是______,______,______
操作Ⅲ中的方法是______,______,______
![]() 所得晶体中碳酸氢钠的纯度是______
所得晶体中碳酸氢钠的纯度是______![]() 不必化简
不必化简![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )
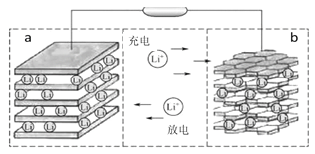
A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵![]() 又称摩尔盐,某实验小组利用如图装置制取摩尔盐并测其纯度。
又称摩尔盐,某实验小组利用如图装置制取摩尔盐并测其纯度。
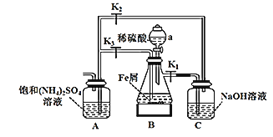
Ⅰ![]() 摩尔盐的制取:
摩尔盐的制取:
(1)仪器a的名称为:_________________
(2)检查装置气密性,加入药品,先关闭![]() ,打开
,打开![]() 、
、![]() 和仪器a活塞,装置B中有气体产生,该气体的作用是______________。反应一段时间后,欲使摩尔盐在装置A中生成的对应操作为___________。
和仪器a活塞,装置B中有气体产生,该气体的作用是______________。反应一段时间后,欲使摩尔盐在装置A中生成的对应操作为___________。
Ⅱ![]() 摩尔盐纯度测定:取
摩尔盐纯度测定:取![]() 硫酸亚铁铵样品配制成
硫酸亚铁铵样品配制成![]() 溶液,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
溶液,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
![]() 甲
甲![]() 方案一:取
方案一:取![]() 硫酸亚铁铵溶液用
硫酸亚铁铵溶液用![]() 的酸性
的酸性![]() 溶液进行三次滴定。
溶液进行三次滴定。
![]() 乙
乙![]() 方案二:
方案二:
![]()

![]() 丙
丙![]() 方案三:实验设计图如图所示:
方案三:实验设计图如图所示:
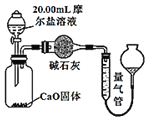
(3)写出方案一发生反应的离子方程式____________,若甲乙两同学实验操作都正确,但方案一的测定结果总是小于方案二,推测可能原因: _________;设计实验验证你的推测:_____________。
(4)方案三测得![]() 的体积为
的体积为![]() 已折算为标准状况下
已折算为标准状况下![]() ,计算摩尔盐的纯度________。
,计算摩尔盐的纯度________。![]() 计算结果保留一位小数
计算结果保留一位小数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com