
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
A.达到化学平衡时,4v正(O2)=5v正(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是____________。
(2)“合成”阶段生成Na2FeO4的离子方程式为___________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性KMnO4溶液进行检验,请分析方案是否合理,并说明理由:____________。
(4)常温下,若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于____。{已知该实验条件下,Ksp[(Fe(OH)3]=6.4×10-36}
(5)在不同温度和不同pH下,FeO42-的稳定性如图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是
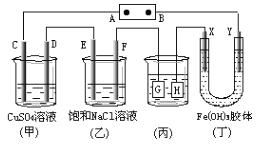
A. 电源B极是正极
B. 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe3O4、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:在酸性条件下,氧化性Co3>Cl2>H2O2>Fe3+。
请回答下列问题:
(1)提高废钴渣溶解速率的措施宜采用_______(填两条)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为________________________。
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的______________溶液(填化学式),____________,洗涤、灼烧得到铁红。
(4)从环境保护角度分析,不用浓盐酸替代硫酸的原因是__________________________。
(5)已知常温下,Ksp[Al(OH)3]≈1.0×1034。当pH=5时,c(Al3)=___________mol·L1。
(6)为了测定CoCl2nH2O中结晶水数目进行如下实验:取16.6 g样品在一定条件下脱水得13.0g CoCl2,则n=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组学生用如下图所示装置制取丙烯酸甲酯,步骤如下:
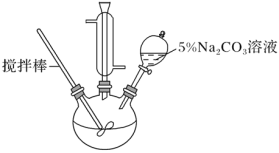
Ⅰ.取10.0 g丙烯酸(CH2=CHCOOH)和6.0 g甲醇、适量的浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
Ⅱ.充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗涤至中性。
Ⅲ.分液,取上层油状液体,加入无水Na2SO4固体,过滤后蒸馏,收集70~90 ℃馏分。
(1) 冷凝管的作用是______
(2) 该实验中可能生成有机副产物的结构简式为____(填一种即可)。
(3) 步骤Ⅱ中混合液用5% Na2CO3溶液洗涤的目的是_______。
(4) 步骤Ⅲ中加入无水Na2SO4固体的作用是______。
(5) 已知甲醇易挥发且有毒性,请写出1条在本实验中需要采取的安全防护措施_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
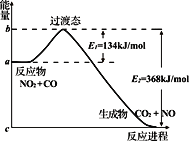
A. 1molNO2与1molCO混合经充分反应放热234 kJ
B. 若反应开始时加入催化剂, 则使E1 、E2 都变大
C. 正反应的活化能是134kJ/mol
D. 该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究![]() 和
和![]() 对
对![]() 分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
图1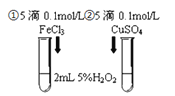 图2
图2 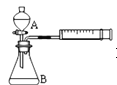
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1所示的实验中反应速率为![]() ,则一定说明
,则一定说明![]() 比
比![]() 对
对![]() 分解催化效果好
分解催化效果好
C.用图2装置比较反应速率可测定在相同状况下反应产生一定气体体积所需反应时间
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在压强为0.1MPa、10L恒容的密闭容器中,将2molCO与5molH2的混合气体在催化剂作用下能生成甲醇CO(g)+2H2(g)=CH3OH(g)△H<0请回答下列问题:
(1)该反应的熵变ΔS_________________0(填“>”、“<”或“=”).
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为_________________mol
②反应的平衡常数K=_________________;
③反应0-5min在区间的平均反应速率v(H2)=_________________
(3)向反应器中再分别充入下列气体,能使CO转化率增大的是_________________
A.CO B.H2 C.CH3OH D.He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:A________、B________、C________、D________。
(2)写出A元素原子的核外电子排布式:____________;写出B元素原子核外电子排布的价电子构型:__________;用电子排布图表示C原子的核外电子排布情况:_______________。
(3)比较四种元素的第一电离能和电负性的大小:第一电离能____________;电负性____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com