
【题目】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe3O4、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:在酸性条件下,氧化性Co3>Cl2>H2O2>Fe3+。
请回答下列问题:
(1)提高废钴渣溶解速率的措施宜采用_______(填两条)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为________________________。
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的______________溶液(填化学式),____________,洗涤、灼烧得到铁红。
(4)从环境保护角度分析,不用浓盐酸替代硫酸的原因是__________________________。
(5)已知常温下,Ksp[Al(OH)3]≈1.0×1034。当pH=5时,c(Al3)=___________mol·L1。
(6)为了测定CoCl2nH2O中结晶水数目进行如下实验:取16.6 g样品在一定条件下脱水得13.0g CoCl2,则n=__________。
【答案】加热、搅拌和适当增大硫酸浓度等 2Co3++H2O2=2Co2++O2↑+2H NaOH 过滤 产生Cl2污染环境 1.0×107 2
【解析】
(1)从影响化学反应的速率的外界因素寻找适当的措施;
(2)氧化性Co3>H2O2,故Co3为氧化剂,H2O2为还原剂,以此写出化学方程式;
(3)滤渣B中含有氢氧化铁和氢氧化铝,氢氧化铝可溶于强碱溶液,以此分离;
(4)由于氧化性Co3>Cl2,使用浓盐酸会产生氯气污染环境;
(5)根据Ksp和pH结合水的离子积计算c(Al3);
(6)根据公式n=m/M,计算CoCl2和H2O的物质的量之比即可。
(1)由影响化学反应的速率的外界因素可知加热、搅拌和适当增大硫酸浓度等可加快溶解速率,故答案为:加热、搅拌和适当增大硫酸浓度等;
(2)由氧化性Co3>H2O2,故Co3为氧化剂生成Co2,H2O2为还原剂生成O2,则化学方程式为:2Co3++H2O2=2Co2++O2↑+2H,故答案为:2Co3++H2O2=2Co2++O2↑+2H;
(3)溶液B中含Fe3、Co2、Al3等调节pH滤渣B中含有氢氧化铁和氢氧化铝,氢氧化铝可溶于强碱溶液,过滤可分离,故答案为:NaOH;过滤;
(4)由于氧化性Co3>Cl2,使用浓盐酸会发生反应:![]() Cl2污染环境,故答案为:产生Cl2污染环境;
Cl2污染环境,故答案为:产生Cl2污染环境;
(5)由![]() 和pH=5结合水的离子积则
和pH=5结合水的离子积则![]() 则铝离子浓度
则铝离子浓度![]() ,故答案为1.0×107 ;
,故答案为1.0×107 ;
(6)![]() ,
,![]() ,
,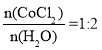 ,故答案为:2。
,故答案为:2。


科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取wgX,加适量水溶解,注入圆底烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mL c1mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)用NaOH标准溶液滴定过剩的HCl时,应使用_______式滴定管,该滴定实验可使用的指示剂为_______,达到滴定终点的现象为____________________________
(2)样品中氨的质量分数表达式为__________________________
(3)滴定终点时,若溶液中c(Ag+)=2.0×10-5mol·L-1 ,c(CrO42-)为________mol·L-1。(已知:Ksp(Ag2CrO4)=1.12×10-12)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中,发生如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
A.平衡体系增加O2对反应的影响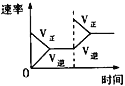
B.温度对反应的影响
C.压强对反应的影(P1>P2)
D.催化剂对反应的影响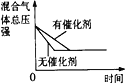
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成某药物的中间体,其合成路线如F(-Ph代表苯基):

(1)已知X是一种环状烃,则其化学名称是___。
(2)Z的分子式为___;N中含氧官能团的名称是__。
(3)反应①的反应类型是__。
(4)写出反应⑥的化学方程式:__。
(5)T是R的同分异构体,同时满足下列条件的T的同分异构体有___种(不包括立体异构)。写出核磁共振氢谱有五个峰的同分异构体的结构简式:___。
a.与氯化铁溶液发生显色反应
b.1molT最多消耗2mol钠
c.同一个碳原子上不连接2个官能团
(6)参照上述合成路线,结合所学知识,以![]() 为原料合成OHCCH2CH2COOH,设计合成路线:___(其他试剂任选)。
为原料合成OHCCH2CH2COOH,设计合成路线:___(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
热量值kJ·mol-1 | 945 | 498 | 630 |
①ΔH 1_____0,ΔH 3_____0。(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=______kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是_______(填字母)。
A. 
B. 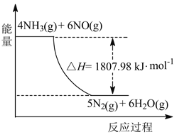
C. 
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=________,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为______kJ。
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为______。
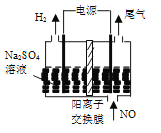
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
A.达到化学平衡时,4v正(O2)=5v正(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com