
【题目】H是合成某药物的中间体,其合成路线如F(-Ph代表苯基):

(1)已知X是一种环状烃,则其化学名称是___。
(2)Z的分子式为___;N中含氧官能团的名称是__。
(3)反应①的反应类型是__。
(4)写出反应⑥的化学方程式:__。
(5)T是R的同分异构体,同时满足下列条件的T的同分异构体有___种(不包括立体异构)。写出核磁共振氢谱有五个峰的同分异构体的结构简式:___。
a.与氯化铁溶液发生显色反应
b.1molT最多消耗2mol钠
c.同一个碳原子上不连接2个官能团
(6)参照上述合成路线,结合所学知识,以![]() 为原料合成OHCCH2CH2COOH,设计合成路线:___(其他试剂任选)。
为原料合成OHCCH2CH2COOH,设计合成路线:___(其他试剂任选)。
【答案】环戊二烯 C7H8O 羰基 加成反应 2 +O2
+O2![]() 2
2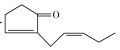 +2H2O 9
+2H2O 9 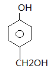
![]()
【解析】
(1)已知X是一种环状烃,分子式为C5H6推断其结构式和名称;
(2)由Z得结构简式可得分子式,由N得结构简式可知含氧官能团为羰基;
(3)反应①的反应类型是X与Cl2C=C=O发生的加成反应;
(4)反应⑥为M的催化氧化;
(5)T中含不饱和度为4与氯化铁溶液发生显色反应则含苯酚结构;1molT最多消耗2mol钠则含有两个羟基;同一个碳原子上不连接2个官能团,以此推断;
(6)运用上述流程中的前三步反应原理合成环丁酯,环丁酯水解、酸化得到OHCCH2CH2COOH。
(1)已知X是一种环状烃,分子式为C5H6,则X为环戊二稀,故答案为环戊二烯;
(2)Z结构式为![]() ,分子式为:C7H8O;由N得结构简式可知含氧官能团为酮键;故答案为:C7H8O;羰基;
,分子式为:C7H8O;由N得结构简式可知含氧官能团为酮键;故答案为:C7H8O;羰基;
(3)反应①的反应类型是X与Cl2C=C=O发生的加成反应;故答案为:加成反应;
(4)反应⑥为M的催化氧化反应方程式为:2 +O2
+O2![]() 2
2 +2H2O,故答案为:2
+2H2O,故答案为:2 +O2
+O2![]() 2
2 +2H2O;
+2H2O;
(5)R中不饱和度为4,T中苯环含有4个不饱和度,与氯化铁溶液发生显色反应则含苯酚结构;1molT最多消耗2mol钠则含有两个羟基;同一个碳原子上不连接2个官能团。则有两种情况,苯环中含有3个取代基则含有两个羟基和一个甲基,共有6种同分异构体;苯环中含有2个取代基则一个为羟基一个为-CH2OH,共有三种同分异构体(邻、间、对),则共有9种同分异构体。核磁共振氢谱有五个峰的同分异构体的结构简式为: 故答案为:9;
故答案为:9; ;
;
(6)参考上述流程中的有关步骤设计,流程为:![]() ,故答案为:
,故答案为:![]() 。
。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。

请回答下列问题:
(1)步骤I中除了2Li + 2H2O=2 Li OH + H2↑反应外,主要发生的化学反应方程式为____________________。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是

A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是
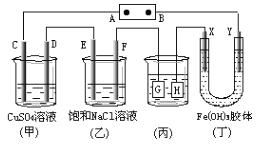
A. 电源B极是正极
B. 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出下列物质的分子式:含6个碳原子的链状单烯烃__________________________。
(2)在戊烷的各种同分异构体中,一氯代物种类最多的键线式是_________________。
(3)用系统命名法命名 :______________
:______________
(4)某化合物的分子式为C5H11Cl,分析数据表明:分子中有两个-CH3、两个-CH2-、一个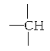 和一个-Cl。它的可能的结构有______________种
和一个-Cl。它的可能的结构有______________种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe3O4、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:在酸性条件下,氧化性Co3>Cl2>H2O2>Fe3+。
请回答下列问题:
(1)提高废钴渣溶解速率的措施宜采用_______(填两条)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为________________________。
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的______________溶液(填化学式),____________,洗涤、灼烧得到铁红。
(4)从环境保护角度分析,不用浓盐酸替代硫酸的原因是__________________________。
(5)已知常温下,Ksp[Al(OH)3]≈1.0×1034。当pH=5时,c(Al3)=___________mol·L1。
(6)为了测定CoCl2nH2O中结晶水数目进行如下实验:取16.6 g样品在一定条件下脱水得13.0g CoCl2,则n=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组学生用如下图所示装置制取丙烯酸甲酯,步骤如下:
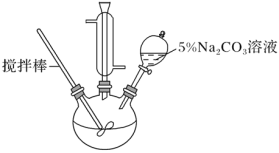
Ⅰ.取10.0 g丙烯酸(CH2=CHCOOH)和6.0 g甲醇、适量的浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
Ⅱ.充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗涤至中性。
Ⅲ.分液,取上层油状液体,加入无水Na2SO4固体,过滤后蒸馏,收集70~90 ℃馏分。
(1) 冷凝管的作用是______
(2) 该实验中可能生成有机副产物的结构简式为____(填一种即可)。
(3) 步骤Ⅱ中混合液用5% Na2CO3溶液洗涤的目的是_______。
(4) 步骤Ⅲ中加入无水Na2SO4固体的作用是______。
(5) 已知甲醇易挥发且有毒性,请写出1条在本实验中需要采取的安全防护措施_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究![]() 和
和![]() 对
对![]() 分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )
图1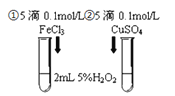 图2
图2 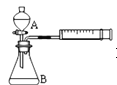
A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图1所示的实验中反应速率为![]() ,则一定说明
,则一定说明![]() 比
比![]() 对
对![]() 分解催化效果好
分解催化效果好
C.用图2装置比较反应速率可测定在相同状况下反应产生一定气体体积所需反应时间
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式,回答下列各问:
① C(s)+1/2O2(g)=CO(g) ΔH =—110.4 kJ/mol
② C(s)+ O2(g)=CO2(g) ΔH =—393.5 kJ/mol
(1)C的燃烧热为______ kJ/mol 。
(2)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧热的热化学方程式__________________________________________________。
(3)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OCH3(g)+H2O(g) = 2CH3OH(g) ΔH2=+23.4 kJ·mol-1
则2CO2(g)+6H2(g) = CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2![]() 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为___________________________________。
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com