
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是
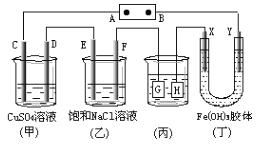
A. 电源B极是正极
B. 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
【答案】D
【解析】A、根据图片知,该装置是电解池,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极附近有大量氢氧根离子,由此得出F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极,故A错误;B、丁装置中Y电极是阴极,如果Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷,故B错误;C、若用(丙)装置给铜镀银,G应该是Ag,H是铜,电镀液是AgNO3溶液,故C错误;D、甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,所以(甲)、(乙)装置的C、D、E、F电极均有单质生成;生成1mol氧气需要4mol电子,生成1mol铜时需要2mol电子,生成1mol氯气时需要2mol电子,生成1mol氢气时需要2mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为1:2:2:2,故D正确;故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,探讨温度对反应的影响,实验结果如下图所示(注:T1,T2均大于300 ℃),下列说法正确的是 ( )。
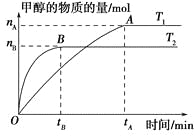
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
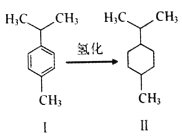
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中,发生如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
A.平衡体系增加O2对反应的影响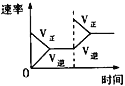
B.温度对反应的影响
C.压强对反应的影(P1>P2)
D.催化剂对反应的影响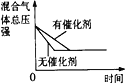
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z的原子序数依次增大,R、Y位于同主族,X2 YR3水溶液在空气中久置,其溶液由碱性变为中性。下列说法正确的是( )
A.简单离了半径:X>Y>Z>R
B.X2Y与Z2反应可证明Z的非金属性比Y强
C.Y的氧化物对应的水化物一定是强酸
D.X和R组成的化合物只含一种化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成某药物的中间体,其合成路线如F(-Ph代表苯基):

(1)已知X是一种环状烃,则其化学名称是___。
(2)Z的分子式为___;N中含氧官能团的名称是__。
(3)反应①的反应类型是__。
(4)写出反应⑥的化学方程式:__。
(5)T是R的同分异构体,同时满足下列条件的T的同分异构体有___种(不包括立体异构)。写出核磁共振氢谱有五个峰的同分异构体的结构简式:___。
a.与氯化铁溶液发生显色反应
b.1molT最多消耗2mol钠
c.同一个碳原子上不连接2个官能团
(6)参照上述合成路线,结合所学知识,以![]() 为原料合成OHCCH2CH2COOH,设计合成路线:___(其他试剂任选)。
为原料合成OHCCH2CH2COOH,设计合成路线:___(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
A.达到化学平衡时,4v正(O2)=5v正(NO)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )
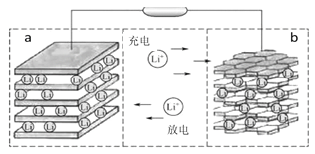
A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com