
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
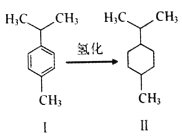
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
科目:高中化学 来源: 题型:
【题目】某气态化合物X含C,H,O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量,欲确定X的分子式,所需的最少条件是 ( )
A.①③⑤B.②③④C.①②④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.Mg的摩尔质量为24
B.物质的量的基本单位是摩尔
C.常温常压下,1 mol O2体积为22.4L
D.将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被称为“21世纪金属”。工业上由钛铁矿(主要成分FeTiO3)制备TiCl4的主要工艺流程如下:

回答下列问题:
(1)已知酸浸反应FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O,则FeTiO3中铁元素的化合价为_____。加热TiOSO4溶液可制备TiO2·nH2O胶体,其反应的化学方程式为__________。为提高钛铁矿的酸浸出率,可采取的办法除粉碎矿石外,还可以采取的办法有__________、_______(写出两种方法)。
(2)加入A的目的是____(填字母)。
A.防止Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解
溶液II经操作II可得副产品FeSO4·7H2O,则操作II包括浓缩、冷却、_____、_____。
(3)常温下,若溶液II中Fe2+的浓度为0.49mol/L,为防止生成Fe(OH)2沉淀,溶液的pH不超过_____。(已知Ksp[Fe(OH)2]=4.9×10-17)
(4)钛酸煅烧得中间产物的化学方程式为H2TiO3(s) ![]() TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
TiO2(s)+H2O(g),上述工艺流程中,氯气与焦炭均足量时生成TiCl4的化学方程式为__________________________。
(5)可利用TiO2通过下述两种方法制备金属钛:
方法一: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g) ![]() TiCl4(g)+O2(g) △ H=+151kJ/mol
TiCl4(g)+O2(g) △ H=+151kJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
方法二:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是___________,可能生成的气体是______________。
从绿色化学角度,你认为上述两种方法中那种更好,并说明理由___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是______。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
采用氢气还原法,请回答如下问题:
(1)xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式______________________________
(2)下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→(_______)(_______)→(_______)(_______)→(_______)(_______)→(_______)(_______)→(_______)(_______)→(l)

(3)23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为__________ g,化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第34号元素,是人体内不可或缺的微量元素,可以形成H2Se、SeO2、H2SeO3、H2SeO4、CuSe等多种化合物。请回答下列问题:
(1)硒在元素周期表中的位置________________________。
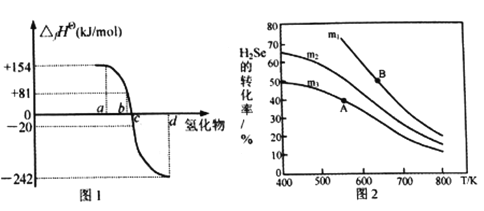
(2)在101kPa、一定温度(一般是298K)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的标准生成热(△fHθ)。图1为氧族元素氢化物a、b、c、d呈气态时的生成热数据。
①图1中氢化物d的电子式为__________________________。
②在298K时,硒化氢分解反应的热化学反应方程式为__________________________。
③由图中数据计算,2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g) △H=_____________KJ/mol
2Se(s)+2H2O(g) △H=_____________KJ/mol
(3)在恒容反应器中,将H2Se(g)和O2(g)按不同比例[n(H2Se)/n(O2)=m]投入反应器,测得反应2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
(4)常温下溶度积:Ksp(CuSe)=7.9x10-49,Ksp(CuS)=1.3×10-36。则反应CuS(s)+Se2-(aq) ![]() CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;![]() H2SO4(浓)+NaOH(aq)===
H2SO4(浓)+NaOH(aq)===![]() Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
A. 上述热化学方程式中的计量数表示分子数。
B. ΔH1>ΔH2
C. ΔH2应为![]() H2SO4(浓)溶于水的能量变化与中和热之和。
H2SO4(浓)溶于水的能量变化与中和热之和。
D. |ΔH1|〈|ΔH2|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热和热化学方程式的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO2(g) =2CO(g)+O2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则分解水的热化学方程式为2H2O(l) =2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D. 1 mol甲烷完全燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com