
【题目】下列关于反应热和热化学方程式的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO2(g) =2CO(g)+O2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则分解水的热化学方程式为2H2O(l) =2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D. 1 mol甲烷完全燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
【答案】B
【解析】在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态H2O时的反应热叫作中和热,中和热是以生成1 mol 液态H2O为基准的,A项错误;CO(g)的燃烧热是283.0 kJ·mol-1,则CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1,则2CO(g)+O2(g)=2CO2(g) ΔH=-2×283.0 kJ·mol-1,逆向反应时反应热的数值相等,符号相反,B项正确;电解2 mol水吸收的热量和2 mol H2完全燃烧生成液态水时放出的热量相等,C项中的ΔH应为+571.0 kJ·mol-1;在25 ℃、101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时(水应为液态)所放出的热量是该物质的燃烧热,D项错误。
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1,则2CO(g)+O2(g)=2CO2(g) ΔH=-2×283.0 kJ·mol-1,逆向反应时反应热的数值相等,符号相反,B项正确;电解2 mol水吸收的热量和2 mol H2完全燃烧生成液态水时放出的热量相等,C项中的ΔH应为+571.0 kJ·mol-1;在25 ℃、101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时(水应为液态)所放出的热量是该物质的燃烧热,D项错误。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】对伞花烃(图I)常用作染料、医药、香料的中间体。下列说法错误的是
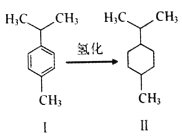
A. 常温对伞花烃呈液态且难溶于水
B. 图Ⅱ物质的一氯代物有5种结构
C. 对伞花烃最多有9个碳原子共平面
D. 图中氢化反应既是加成反应又是还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:C(s)+CO2(g) ![]() 2CO(g),下列说法不正确的是( )
2CO(g),下列说法不正确的是( )
A. 增大CO2浓度可以加快反应速率
B. 升高温度可以加快反应速率
C. 容器体积不变时,向其中充入N2,反应速率不变
D. 增加碳的质量可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
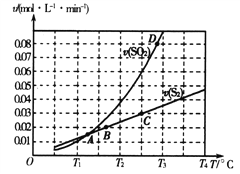
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=______(![]() ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的![]() =_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8

①写出电解NH4HSO4溶液的化学方程式____________。
②若用9.65A的恒定电流电解饱和NH4HSO4溶液1小时,理论上生成的(NH4)2S2O8的物质的量为________。(F=96500C·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种医药中间体,由芳香化合物A制备G的一种合成路线如下:

回答下列问题:已知:①酯能被LiAlH4还原为醇
②
(1)A的化学名称_________________。
(2)C的结构简式_______________,由B生成C的反应类型_____________。
(3)由F生成G的反应方程式_____________________。
(4)芳香化合物X是C的同分异构体,1mol X与足量碳酸氢钠溶液反应生成88g CO2,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比为3:1:1的有________种,写出1种符合要求的X的结构简式__________________。
(5)参照上述合成路线,写出用甲醇和苯甲醇为原料制备化合物 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用如图1所示装置进行第一组实验:
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是_______(填字母序号)。
A. 铝 B. 石墨 C. 银 D. 铂
(2)M极发生反应的电极反应式为________;
(3)实验过程中,SO42﹣________(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有___________________,写出产生此现象的反应方程式:__________________;
Ⅱ.用如图2所示装置进行第二组实验:
(4)实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42﹣)在溶液中呈紫红色。电解过程中,X极区溶液的pH________(填“增大”、“减小”或“不变”);
(5)电解过程中,Y极发生的电极反应为Fe﹣6e﹣+8OH﹣═FeO42﹣+4H2O 和 4OH﹣﹣4e﹣═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极的电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com