
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
��������ͼ1��ʾװ�ý��е�һ��ʵ����
��1���ڱ�֤�缫��Ӧ���������£��������Cu���缫����_______������ĸ��ţ���
A. �� B. ʯī C. �� D. ��
��2��M��������Ӧ�ĵ缫��ӦʽΪ________��
��3��ʵ������У�SO42��________�����������������������������������������ƶ�����ֽ���ܹ۲쵽��������___________________��д������������ķ�Ӧ����ʽ��__________________��
��������ͼ2��ʾװ�ý��еڶ���ʵ����
��4��ʵ������У������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ�������������Ϸ��֣����������FeO42��������Һ�г��Ϻ�ɫ���������У�X������Һ��pH________������������������С����������������
��5���������У�Y�������ĵ缫��ӦΪFe��6e��+8OH���TFeO42��+4H2O �� 4OH����4e���T2H2O+O2��������X���ռ���672mL���壬��Y���ռ���168mL���壨��������Ϊ��״��ʱ�������������Y�缫�����缫����������________g��
��6���ڼ���п����У��ø��������Ϊ�������ϣ�����ܷ�ӦΪ��2K2FeO4+3Zn�TFe2O3+ZnO+2K2ZnO2 �õ�������ĵ缫��ӦʽΪ________��
���𰸡� A Fe��2e��+ 2OH��= Fe(OH)2 �������� ��ֽ���к��ɫ�ߵ���� 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ���� 0.28 2FeO42��+ 6e��+ 5H2O �T Fe2O3 + 10OH��
������������(1)Ҫ��֤�缫��Ӧ���䣬�ܹ����Cu���缫�ı����DZ�Zn�����õĵ���������������Zn������������ʯī�����������������Cu��������������Zn���ã����Բ������Cu����������ȷ��ΪA��
(2)M����Cu��Znԭ��ص�����Cu������������������Ϊ���Խ����缫����ʧȥ��������Fe2+������Һ��OH���������Fe(OH)2�����Ե缫��ӦʽΪFe��2e��+2OH��= Fe(OH)2��
(3)��ԭ����ڲ��ĵ������Һ�У����������ƶ�������SO42��ͨ����Ĥ���������ƶ����ڵ���NaOH��Һ����ֽ�ϣ�M�����������ɵ�Fe(OH)2��Ѹ�ٱ�Ϊ����ɫ��Ȼ���Ϊ���ɫ��N�������������������۲첻������������ֽ���ܹ۲쵽���������ȱ����ɫ��Ȼ���Ϊ���ɫ����Ӧ�ķ���ʽΪ4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3��
����(4)��װ��ͼ��֪X(C)Ϊ������Y(Fe)Ϊ��������������֪��ʧȥ���ӽ��OH-�����ɸ��������FeO42������ʹ��Һ���Ϻ�ɫ��������X(C)������H+�õ���������������ʹ��Һ�е�c(H+)��С��pH������
(5)����X���ռ���672mL��������0.03mol����õ�����n(e��)=0.06mol, ��Y���ռ���168mL��������0.0075mol����ʧȥ����n(e��)=0.03mol�����ݵ���ת���غ�ɵã���ʧȥ�ĵ���n(e��)=0.03mol���ɵ缫��ӦʽFe��6e��+8OH���TFeO42��+4H2O��������ܽ���ٵ�����m(Fe)= ![]() = 0.28g��
= 0.28g��
(6)��Ϊ�Ǽ��Ե�أ�OH������Zn����ϵ�ص��ܷ�Ӧʽ��֪��������ӦʽΪ3Zn��6e��+ 10OH��= ZnO+2ZnO22- + 5H2O�����ܷ�Ӧʽ��������Ӧʽ����������ӦʽΪ2FeO42��+ 6e��+ 5H2O �T Fe2O3 + 10OH����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��H��(aq)��OH��(aq)===H2O(l)����H1����57.3 mol��L��1��![]() H2SO4(Ũ)��NaOH(aq)===
H2SO4(Ũ)��NaOH(aq)===![]() Na2SO4(aq)��H2O(l)����H2��m������˵������ȷ����
Na2SO4(aq)��H2O(l)����H2��m������˵������ȷ����
A. �����Ȼ�ѧ����ʽ�еļ�������ʾ��������
B. ��H1>��H2
C. ��H2ӦΪ![]() H2SO4(Ũ)����ˮ�������仯���к���֮����
H2SO4(Ũ)����ˮ�������仯���к���֮����
D. |��H1|��|��H2|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ�Ӧ�Ⱥ��Ȼ�ѧ����ʽ����������ȷ������ ��
A. HCl��NaOH��Ӧ���к�����H=-57.3 kJ��mol-1����H2SO4��Ca(OH)2��Ӧ�ķ�Ӧ����H=2��(-57.3) kJ��mol-1
B. CO(g)��ȼ������283.0 kJ��mol-1����Ӧ2CO2(g) =2CO(g)+O2(g)����H=+2��283.0 kJ��mol-1
C. ������ȼ����Ϊ285.5 kJ��mol-1����ֽ�ˮ���Ȼ�ѧ����ʽΪ2H2O(l) =2H2(g)+O2(g) ��H=+285.5 kJ��mol-1
D. 1 mol������ȫȼ��������̬ˮ�Ͷ�����̼ʱ���ų��������Ǽ����ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ǵ�ǰ����Դ�����о���һ�����Ų��ϡ���һ�������£���Cu-Znԭ�������Դ������ͼ��ʾװ�ÿ�ʵ���л���Ĵ��⣬�����й�˵����ȷ���ǣ� ��
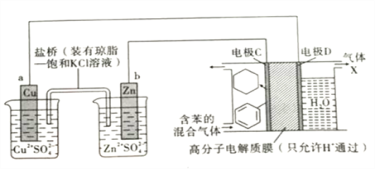
A����Cu-Znԭ���װ�ù���ʱ�������ڵ�Cl-��ͭ�缫һ���ƶ�
B���缫CΪ�������ڵ缫D�Ϸ�����ԭ��Ӧ
C������X����Ҫ�ɷ���H2
D��H+���߷���Ĥ�����ҽ������ң��ڵ缫C�Ϸ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.������أ�K2FeO4����һ�����͡���Ч�������ɫ����ˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
��1���ɷ��Ʊ�������ص���Ҫ��ӦΪ��2FeSO4�� 6Na2O2=2Na2FeO4��2Na2O��2Na2SO4��O2�����÷�Ӧ�й������ƣ�Na2O2������Ԫ�ػ��ϼ�Ϊ______������������________________���ѧʽ����
��2��ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ�����������ӣ�Fe(OH)3��ClO����OH����FeO42����Cl����H2O��
�ټ��������£��������ͻ�ԭ�������ʵ����ı�Ϊ3:2������Ӧ��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��_____________________________________________��
��ÿ����1 mol FeO42��ת��________mol���ӣ�����Ӧ������ת����0.3 mol���ӣ���ԭ��������ʵ���Ϊ________mol��
��.��֪��2Fe3++2I-=2Fe2++I2 ,2Fe2++Br2=2Fe3++2Br-��
(1)����1 mol FeI2��2 mol FeBr2����Һ��ͨ��2 mol Cl2����ʱ��������������________��
(2)����a mol FeI2��b mol FeBr2����Һ��ͨ��c mol Cl2����I-��Fe2+��Br-��ȫ������ʱ��cΪ__________________���ú�a��b�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ绯ѧԭ�����л���ˮ�е��Ҷ���[H2N(CH2)2NH2]ת��Ϊ�����ʵ�ԭ��ʾ��ͼ����ͼ1��ʾ��ͬʱ���ø�װ����ʵ�ֶ�ͭ����ʾ��ͼ��ͼ2��ʾ������ع���ʱ������˵����ȷ����

A. ͼ1��H+�����ӽ���Ĥ���������ƶ�
B. ����һ��ʱ���ͼ2��CuSO4��ҺŨ�ȼ�С
C. ��Y�缫����0.5 mol O2ʱ�����缫����64 g
D. X �缫��Ӧʽ:H2N��CH2��2NH2+16e-+4H2O�T2CO2��+N2��+16H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(NOCl)�����ںϳ�����������������һ�������ڳ��³�ѹ�ºϳɡ��۵㣺-64.5�棬�е㣺-5.5��;�������ǻ�ɫ���ж����壬��ˮ��ˮ�⡣��֪NO����NaOH��Һ��Ӧ���밴Ҫ��ش��������⡣
(1)������м��ϡ�����ַ�Ӧ�Ʊ�NO�����ӷ���ʽΪ_____________������������ͬ��ѡ����Ƭ��ͭƬ�Ʊ�NO���ŵ���_______________��
(2)�Ʊ�NOCl��װ������ͼ��ʾ������˳��Ϊa��_______________(�������������ҷ�����Сд��ĸ��ʾ��
��װ��A�з�Ӧ�Ļ�ѧ����ʽ��_______________��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ�������ĵ���ʽΪ_______________��
����ʵ����û�а�װװ��B��������_______________��
��ʵ�鿪ʼӦ����װ����ͨ��Cl2����װ��A�г�������ɫ����ʱ���ٽ�NO����ͨ�룬�˲�����Ŀ����_______________��
(3)��ҵ����������NOβ�����������ж��֣����м�ӵ绯ѧ������ԭ����ͼ��ʾ��
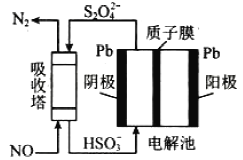
���������ڷ����ķ�ӦΪ_______________��
�������ĵ缫��ӦʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԥ����������Һ������ԣ������ܷ���ˮ�ⷴӦ����д��ˮ�ⷴӦ�����ӷ���ʽ
��1���������Һ_________________________________��
��2����������Һ_________________________________��
��3���Ȼ�����Һ_________________________________��
��4���廯����Һ__________________________________��
��5������Һ__________________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com