
����Ŀ����������(NOCl)�����ںϳ�����������������һ�������ڳ��³�ѹ�ºϳɡ��۵㣺-64.5�棬�е㣺-5.5��;�������ǻ�ɫ���ж����壬��ˮ��ˮ�⡣��֪NO����NaOH��Һ��Ӧ���밴Ҫ��ش��������⡣
(1)������м��ϡ�����ַ�Ӧ�Ʊ�NO�����ӷ���ʽΪ_____________������������ͬ��ѡ����Ƭ��ͭƬ�Ʊ�NO���ŵ���_______________��
(2)�Ʊ�NOCl��װ������ͼ��ʾ������˳��Ϊa��_______________(�������������ҷ�����Сд��ĸ��ʾ��
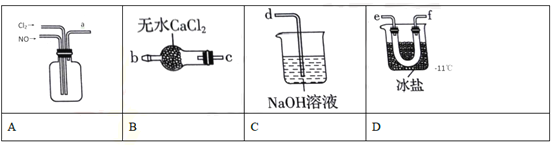
��װ��A�з�Ӧ�Ļ�ѧ����ʽ��_______________��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ�������ĵ���ʽΪ_______________��
����ʵ����û�а�װװ��B��������_______________��
��ʵ�鿪ʼӦ����װ����ͨ��Cl2����װ��A�г�������ɫ����ʱ���ٽ�NO����ͨ�룬�˲�����Ŀ����_______________��
(3)��ҵ����������NOβ�����������ж��֣����м�ӵ绯ѧ������ԭ����ͼ��ʾ��
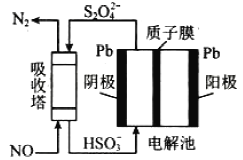
���������ڷ����ķ�ӦΪ_______________��
�������ĵ缫��ӦʽΪ_______________��
���𰸡� 3Fe+8H++2NO3-=3Fe2++2NO��+4H2O ��ͬ�����£�������NO ��ͭ�� e��f(��f��e)��c��b��d Cl2+2NO==2NOCl ![]() ˮ�������뷴Ӧ�������NOCl ˮ�� ����װ���п�������ֹ�����е�O2 ��NO ��Ӧ 2NO+2S2O42+2H2O=N2+4HSO3 2HSO3+ 2H+ + 2e= S2O42+ 2H2O
ˮ�������뷴Ӧ�������NOCl ˮ�� ����װ���п�������ֹ�����е�O2 ��NO ��Ӧ 2NO+2S2O42+2H2O=N2+4HSO3 2HSO3+ 2H+ + 2e= S2O42+ 2H2O
�����������������(1) ������м��ϡ�����ַ�Ӧ��������������һ��������ˮ����ͬ������������NO�����ͭ�ࣻ(2) ������һ��������A������NOCl��NOCl�е㣺-5.5���������ñ���ˮ�ռ�NOCl��NOCl��ˮ��ˮ����Ϊ��ֹNOClˮ������β������ǰ���Ӹ���װ���� NO���� O2��Ӧ����NO2��(3) �ٸ���ͼʾ����������NO��S2O42��Ӧ����N2��HSO3��������HSO3�õ�������S2O42��
������(1) ������м��ϡ�����ַ�Ӧ��������������һ��������ˮ����Ӧ���ӷ���ʽ��3Fe+8H++2NO3-=3Fe2++2NO��+4H2O��ѡ����Ƭ��ͭƬ�Ʊ�NO���ŵ��ǣ���ͬ������������NO�����ͭ�ࣻ(2) ������һ��������A������NOCl��NOCl�е㣺-5.5���������ñ���ˮ�ռ�NOCl��NOCl��ˮ��ˮ����Ϊ��ֹNOClˮ������β������ǰ���Ӹ���װ������������˳����e��f(��f��e)��c��b��d����װ��A��������һ��������Ӧ����NOCl����ѧ����ʽ��Cl2+2NO==2NOCl��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ�����ݳɼ�����������ʽΪ![]() ����NOCl��ˮ��ˮ������ʵ����û�а�װװ��B��ˮ�������뷴Ӧ�������NOCl ˮ������ʵ�鿪ʼӦ����װ����ͨ��Cl2����װ��A�г�������ɫ����ʱ���ٽ�NO����ͨ�룬���Է�ֹ��ֹ�����е�O2 ��NO ��Ӧ�� (3) �ٸ���ͼʾ����������NO��S2O42��Ӧ����N2��HSO3����Ӧ���ӷ���ʽ��2NO+2S2O42+2H2O=N2+4HSO3��������HSO3�õ�������S2O42��������Ӧʽ��2HSO3+ 2H+ + 2e= S2O42+ 2H2O��
����NOCl��ˮ��ˮ������ʵ����û�а�װװ��B��ˮ�������뷴Ӧ�������NOCl ˮ������ʵ�鿪ʼӦ����װ����ͨ��Cl2����װ��A�г�������ɫ����ʱ���ٽ�NO����ͨ�룬���Է�ֹ��ֹ�����е�O2 ��NO ��Ӧ�� (3) �ٸ���ͼʾ����������NO��S2O42��Ӧ����N2��HSO3����Ӧ���ӷ���ʽ��2NO+2S2O42+2H2O=N2+4HSO3��������HSO3�õ�������S2O42��������Ӧʽ��2HSO3+ 2H+ + 2e= S2O42+ 2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǰ뵼���绯ѧ��ع��ˮ����ķ�Ӧԭ��ʾ��ͼ���ڹ����£������ɼ۴�ԾǨ��������Ȼ������Ե缫������˵������ȷ����

A. �Ե缫�ĵ缫��ӦʽΪ��2H++2e��=H2��
B. �뵼��缫������ԭ��Ӧ
C. �������Һ����������Ե缫�ƶ�
D. ����������ʵ����̫���ܡ����ܡ���ѧ�ܵ�ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С��ֱ�����ͼ��ʾװ�ö�ԭ��غ͵��ԭ������ʵ��̽����

��ش�
��������ͼ1��ʾװ�ý��е�һ��ʵ����
��1���ڱ�֤�缫��Ӧ���������£��������Cu���缫����_______������ĸ��ţ���
A. �� B. ʯī C. �� D. ��
��2��M��������Ӧ�ĵ缫��ӦʽΪ________��
��3��ʵ������У�SO42��________�����������������������������������������ƶ�����ֽ���ܹ۲쵽��������___________________��д������������ķ�Ӧ����ʽ��__________________��
��������ͼ2��ʾװ�ý��еڶ���ʵ����
��4��ʵ������У������������������Y������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ��Ȼ�������������Ϸ��֣����������FeO42��������Һ�г��Ϻ�ɫ���������У�X������Һ��pH________������������������С����������������
��5���������У�Y�������ĵ缫��ӦΪFe��6e��+8OH���TFeO42��+4H2O �� 4OH����4e���T2H2O+O2��������X���ռ���672mL���壬��Y���ռ���168mL���壨��������Ϊ��״��ʱ�������������Y�缫�����缫����������________g��
��6���ڼ���п����У��ø��������Ϊ�������ϣ�����ܷ�ӦΪ��2K2FeO4+3Zn�TFe2O3+ZnO+2K2ZnO2 �õ�������ĵ缫��ӦʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ����
A. CH4ȼ�� B. ϡ�����NaOH��Һ��Ӧ
C. ����ʯ��ʯ D. Zn��ϡ���ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�м����Ȼ�����Һ���ɰ�ɫ�������ټ���ϡ����������ܽ�Ҳ�������ݳ�����������Һ�У�������
A.һ������SO42��
B.һ������Ag+
C.���ܲ���CO32��
D.���ܺ���SO42����Ag+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ơ�Ƶ���Ҫ�ɷ��к��оƾ���CH3CH2OH�������Ĺ������ǣ� ��
A.��COOHB.��OHC.��CH3D.��CH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͨ������³ʻ���ɫ����
A. ���� B. ���� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������м������ʣ�A.ʯī�ͽ��ʯ B. 35Cl��37Cl C��CH3CH=CHCH3�ͣ�CH3��2C=CH2 D�������������E. 
��1������ͬ�����������__________________
��2������ͬλ�ص���__________________
��3������ͬ���칹�����__________________
��4������ͬϵ�����__________________
��5������ͬ�����ʵ���__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���μ�������ˮ�����и������ӿ��ܴ������ڵ��ǣ�������
A.Fe3+��Cl����NO3��
B.Na+��HCO3����SO42��
C.Ag+��NH4+��NO3��
D.Na+��SO32����SO42��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com