
【题目】下列试剂可用于除去乙烷气体中的乙烯气体的是
A.溴水B.溴的四氯化碳溶液C.酸性高锰酸钾溶液D.氢气
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.Mg的摩尔质量为24
B.物质的量的基本单位是摩尔
C.常温常压下,1 mol O2体积为22.4L
D.将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第34号元素,是人体内不可或缺的微量元素,可以形成H2Se、SeO2、H2SeO3、H2SeO4、CuSe等多种化合物。请回答下列问题:
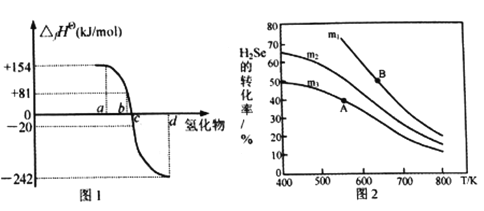
(1)硒在元素周期表中的位置________________________。
(2)在101kPa、一定温度(一般是298K)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的标准生成热(△fHθ)。图1为氧族元素氢化物a、b、c、d呈气态时的生成热数据。
①图1中氢化物d的电子式为__________________________。
②在298K时,硒化氢分解反应的热化学反应方程式为__________________________。
③由图中数据计算,2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g) △H=_____________KJ/mol
2Se(s)+2H2O(g) △H=_____________KJ/mol
(3)在恒容反应器中,将H2Se(g)和O2(g)按不同比例[n(H2Se)/n(O2)=m]投入反应器,测得反应2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
(4)常温下溶度积:Ksp(CuSe)=7.9x10-49,Ksp(CuS)=1.3×10-36。则反应CuS(s)+Se2-(aq) ![]() CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;![]() H2SO4(浓)+NaOH(aq)===
H2SO4(浓)+NaOH(aq)===![]() Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是
A. 上述热化学方程式中的计量数表示分子数。
B. ΔH1>ΔH2
C. ΔH2应为![]() H2SO4(浓)溶于水的能量变化与中和热之和。
H2SO4(浓)溶于水的能量变化与中和热之和。
D. |ΔH1|〈|ΔH2|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X表示某物,Y表示X物质中含有的少量杂,Z表示要除去杂质加入的试剂,其中正确的组别是( )
X | Y | Z | |
A | FeCl2 溶液 | FeCl3 | KSCN 溶液 |
B | H2 | SO2 | NaOH 溶液 |
C | Fe2(SO4)3溶液 | FeSO4 | Cl2 |
D | SiO2 | Fe2O3 | NaOH 溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d为短周期元素,原子序数依次增大。25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1)的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:b>a
B. d元素氧化物的水化物一定是强酸
C. 气态氢化物的稳定性:d>c
D. b、c的简单离子都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热和热化学方程式的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO2(g) =2CO(g)+O2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则分解水的热化学方程式为2H2O(l) =2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D. 1 mol甲烷完全燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电化学原理将有机废水中的乙二胺[H2N(CH2)2NH2]转化为无毒物质的原理示意图如下图1所示,同时利用该装置再实现镀铜工艺示意图如图2所示,当电池工作时,下列说法正确的是

A. 图1中H+透过质子交换膜由右向左移动
B. 工作一段时间后,图2中CuSO4溶液浓度减小
C. 当Y电极消耗0.5 mol O2时,铁电极增重64 g
D. X 电极反应式:H2N(CH2)2NH2+16e-+4H2O═2CO2↑+N2↑+16H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com