
【题目】下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是( )
①过滤 ②蒸发 ③向容量瓶转移液体.
A.①和③
B.①和②
C.②和③
D.①②③
科目:高中化学 来源: 题型:
【题目】镍是重要的合金元素,可制作镍铬、镍铝等合金,镍也常用作有机加氢的催化剂及制取配合物。
(1)写出基态Cr的简化电子排布式__________,Cr中共有__________种不同能级的电子。
(2)Ni(CO)n与Fe(CO)5同属金属羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。
①Ni、C、O的电负性由大到小的顺序为____________________。
② Ni(CO)n分子中n=__________。
③已知Ni2+和Fe2+的离子半径分别为69pm和78pm,根据岩浆晶出规则熔融的NiO和FeO岩浆在冷却过程中,NiO更容易先结晶,试解释其原因____________________。
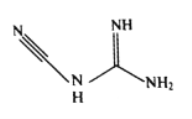
(3)检定镍、钴、铜钯等可用双氰胺,化学式C2H4N4,其结构简式如图所示。双氰胺分子中碳原子的杂化方式有__________,分子结构中键能最大的共价键是__________。
(4)镍的晶体结构、镍铝合金的晶胞如图所示。
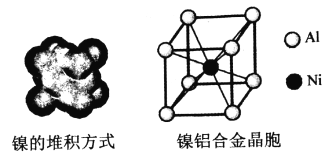
①镍晶体的堆积方式为__________。
②已知Al的第一、第二电离能分别为:l1=578kJ/mol,l2=1817kJ/mol,简述l2远大于l1的原因__________________________________________________。
③已知:镍铝合金密度为dg/cm3,NA代表阿伏伽德罗常数,则铝镍的核间距为__________ pm。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
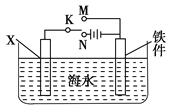
①开关K断开时,且若为生铁,则铁件主要发生_____腐蚀;若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜(含锌等杂质),容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加127 g时,X电极溶解的铜的质量________127 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
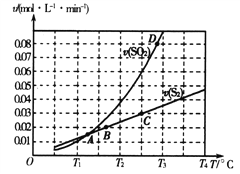
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=______(![]() ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的![]() =_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8

①写出电解NH4HSO4溶液的化学方程式____________。
②若用9.65A的恒定电流电解饱和NH4HSO4溶液1小时,理论上生成的(NH4)2S2O8的物质的量为________。(F=96500C·mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com