
【题目】氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
热量值kJ·mol-1 | 945 | 498 | 630 |
①ΔH 1_____0,ΔH 3_____0。(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=______kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是_______(填字母)。
A. 
B. 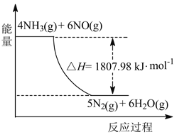
C. 
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=________,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为______kJ。
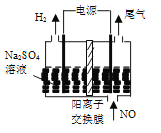
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为______。
【答案】> < 183 B -867 kJ·mol-1 95.5 2NO+4H2O![]() 2HNO3+3H2
2HNO3+3H2
【解析】
(1)①断裂化学键需要吸收能量,形成化学键需要放出能量;
②盖斯定律计算得到反应的焓变;
(2) 4NH3 (g) +6NO (g) =5N2 (g)+6H2O (g) △H=-1807.98kJ.mol-1,反应为放热反应,反应物能量高于生成物,据此分析判断图象;
(3) 根据盖斯定律计算,由(①+②)×![]() -③×2得反应;
-③×2得反应;
(4)阳极上一氧化氮失电子生成硝酸,阴极上氢离子得到电子生成氢气,结合电荷守恒和原子守恒配平书写电极反应,得到反应的化学方程式。
(1)①N2(g)→2N(g)是断裂化学键吸收能量,△H1 >0,N(g)+O(g)→NO(g)是形成化学键放出能量,△H3 < 0;
②Ⅰ、N2(g)→2N(g) △H1 = +945kJ/mol;
Ⅱ、O2(g)→2O(g) △H2 = 498kJ/mol;
Ⅲ、N(g)+O(g)→NO(g) △H3 = -630kJ/ mol;
盖斯定律计算Ⅰ+Ⅱ +2×Ⅲ得到N2(g)+O2(g) = 2NO(g) △H =+183kJ/mol;
(2) 4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,反应为放热反应,反应物能量高于生成物,反应焓变为负值为-1807.98 kJ·mol-1,
答案选B;
(3)①CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH= -574 kJ·mol-1
②CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
盖斯定律计算(①+②)×![]() -③×2得到CH4与NO2反应生成N2(g)和H2O(g)的热化学方程式:CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l) △H=-955 kJ·mol-1;
-③×2得到CH4与NO2反应生成N2(g)和H2O(g)的热化学方程式:CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l) △H=-955 kJ·mol-1;
1mol CH4还原二氧化氮生成N2和液态水放出热量955kJ,1.6gCH4物质的量![]() = 0.1mol,还原NO2生成N2和液态水时放出的热量为95.5kJ;
= 0.1mol,还原NO2生成N2和液态水时放出的热量为95.5kJ;
(4)电解过程中阳极反应中NO转化为硝酸的电极反应式为: NO- 3e- + 2H2O =NO3- +4H+,阴极电极反应为:2H++2e-=H2↑,电解过程中NO转化为硝酸的化学方程式为: 2NO+4H2O![]() 2HNO3+3H2。
2HNO3+3H2。


科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
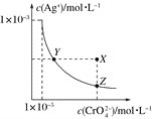
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:浓硫酸形成的酸雾中含有少量的H2SO4分子。某小组拟设计实验探究该资料的真实性并探究SO2的性质,实验装置如图所示(装置中试剂均足量,夹持装置已省略)。

请回答下列问题:
(1)检验A装置气密性的方法是__;A装置中发生反应的化学方程式为___。
(2)实验过程中,旋转分液漏斗活塞之前要排尽装置内空气,其操作是__。
(3)能证明该资料真实、有效的实验现象是___。
(4)本实验制备SO2,利用的浓硫酸的性质有___(填字母)。
a.强氧化性 b.脱水性 c.吸水性 d.强酸性
(5)实验中观察到C中产生白色沉淀,取少量白色沉淀于试管中,滴加___的水溶液(填化学式),观察到白色沉淀不溶解,证明白色沉淀是BaSO4。写出生成白色沉淀的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe3O4、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:在酸性条件下,氧化性Co3>Cl2>H2O2>Fe3+。
请回答下列问题:
(1)提高废钴渣溶解速率的措施宜采用_______(填两条)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为________________________。
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的______________溶液(填化学式),____________,洗涤、灼烧得到铁红。
(4)从环境保护角度分析,不用浓盐酸替代硫酸的原因是__________________________。
(5)已知常温下,Ksp[Al(OH)3]≈1.0×1034。当pH=5时,c(Al3)=___________mol·L1。
(6)为了测定CoCl2nH2O中结晶水数目进行如下实验:取16.6 g样品在一定条件下脱水得13.0g CoCl2,则n=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)(正反应为放热反应),下图是某一时间段反应速率与反应进程的关系曲线图。
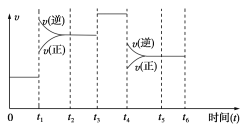
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1________,t3________,t4________。
(2)下列时间段中,氨的百分含量最高的是( )
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
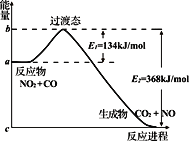
A. 1molNO2与1molCO混合经充分反应放热234 kJ
B. 若反应开始时加入催化剂, 则使E1 、E2 都变大
C. 正反应的活化能是134kJ/mol
D. 该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
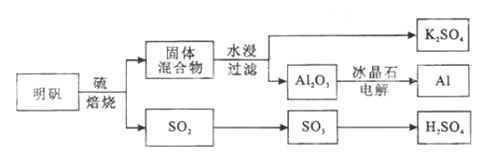
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
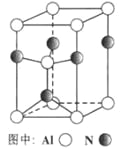
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com