
【题目】资料显示:浓硫酸形成的酸雾中含有少量的H2SO4分子。某小组拟设计实验探究该资料的真实性并探究SO2的性质,实验装置如图所示(装置中试剂均足量,夹持装置已省略)。

请回答下列问题:
(1)检验A装置气密性的方法是__;A装置中发生反应的化学方程式为___。
(2)实验过程中,旋转分液漏斗活塞之前要排尽装置内空气,其操作是__。
(3)能证明该资料真实、有效的实验现象是___。
(4)本实验制备SO2,利用的浓硫酸的性质有___(填字母)。
a.强氧化性 b.脱水性 c.吸水性 d.强酸性
(5)实验中观察到C中产生白色沉淀,取少量白色沉淀于试管中,滴加___的水溶液(填化学式),观察到白色沉淀不溶解,证明白色沉淀是BaSO4。写出生成白色沉淀的离子方程式:___。
【答案】关闭止水夹,将右侧导管插入盛水烧杯中,微热容器,若烧杯中有气泡产生,冷却后能形成一段水柱,则证明容器气密性良好 ![]() 打开止水夹K,向装置中通入一段时间N2 B中溶液出现白色沉淀,且不溶解 cd HCl
打开止水夹K,向装置中通入一段时间N2 B中溶液出现白色沉淀,且不溶解 cd HCl ![]()
【解析】
(1)检验装置气密性可利用内外气压差检验,装置A反生反应:![]() ;
;
(2)利用N2排尽装置内空气;
(3)如有H2SO4分子则B中有沉淀生成;
(4)制备SO2,利用的浓硫酸的强酸制弱酸,还利用浓硫酸的吸水性减少SO2在水中的溶解;
(5)SO2与Ba(NO3)2的水溶液发生氧化还原反应生成BaSO4沉淀,可滴加稀盐酸证明。
(1)检验装置气密性可利用内外气压差检验具体操作为:关闭止水夹,将右侧导管插入盛水烧杯中,微热容器,若烧杯中有气泡产生,冷却后能形成一段水柱,则证明容器气密性良好;装置A反生反应:![]() ;故答案为:关闭止水夹,将右侧导管插入盛水烧杯中,微热容器,若烧杯中有气泡产生,则证明容器气密性良好;
;故答案为:关闭止水夹,将右侧导管插入盛水烧杯中,微热容器,若烧杯中有气泡产生,则证明容器气密性良好;![]() ;
;
(2)实验过程中,旋转分液漏斗活塞之前要排尽装置内空气,其操作是:打开止水夹K,向装置中通入一段时间N2;故答案为:打开止水夹K,向装置中通入一段时间N2;
(3)SO2不与B中物质反应,若有H2SO4分子则B中有沉淀生成,则能证明该资料真实、有效的实验现象是:B中溶液出现白色沉淀,且不溶解;故答案为:B中溶液出现白色沉淀,且不溶解;
(4)制备SO2,利用的浓硫酸的强酸制弱酸,还利用浓硫酸的吸水性减少SO2在水中的溶解;故答案选:cd;
(5)C中沉淀可能为BaSO3或BaSO4不能用稀硫酸或稀硝酸鉴别,可用稀盐酸鉴别;C中反应为:![]() ;故答案为:HCl;
;故答案为:HCl;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A.Li原子的核外电子排布式写成1s3违背了能量最低原理
B.电子的吸收光谱和发射光谱总称原子光谱
C.处于基态的氧原子电子排布图表示成![]() ,违背了泡利原理
,违背了泡利原理
D.某种基态原子中可能存在运动状态完全相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是( )
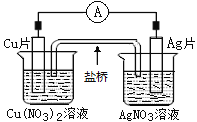
A.电子沿导线由Cu片流向Ag片
B.盐桥中的K+向Cu(NO3)2溶液
C.正极的电极反应是Ag++e-=Ag
D.Cu片上发生氧化反应,Ag片上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是( )
A. 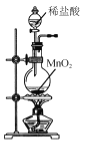 制取Cl2
制取Cl2
B. 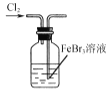 使Br-转化为Br2
使Br-转化为Br2
C.  分液,先放出水层,再倒出溴的苯溶液
分液,先放出水层,再倒出溴的苯溶液
D.  将分液后的水层蒸干获得无水FeCl3
将分液后的水层蒸干获得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关,下列说法正确的是
A.“红柿摘下未熟,每篮用木瓜三枚故入,得气即发,并无涩味”,其中“气”是指乙酸乙酯
B.将碘酒滴到未成熟的苹果肉上变蓝说明苹果肉中含有淀粉
C.“丹砂烧之成水银,积变又还成丹砂”只涉及物理变化
D.食用黑芝麻糊时可加入白砂糖作配料,白砂糖的上要成分是麦芽糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
热量值kJ·mol-1 | 945 | 498 | 630 |
①ΔH 1_____0,ΔH 3_____0。(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=______kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是_______(填字母)。
A. 
B. 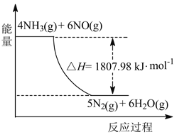
C. 
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=________,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为______kJ。
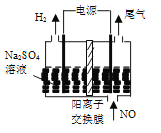
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
改变条件 | 新平衡与原平衡比较 | |
A | 增大压强 | N2的浓度一定变小 |
B | 升高温度 | N2的转化率变小 |
C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
D | 使用适当催化剂 | NH3的体积分数增大 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
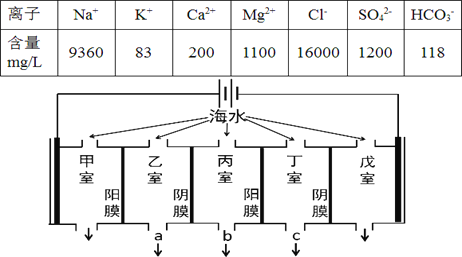
A. 甲室的电极反应式为:2Cl--2e-= Cl2↑
B. 淡化过程中易在戊室形成水垢
C. 乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D. 当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com