
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是( )
A. 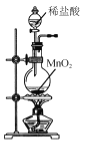 制取Cl2
制取Cl2
B. 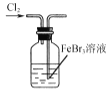 使Br-转化为Br2
使Br-转化为Br2
C.  分液,先放出水层,再倒出溴的苯溶液
分液,先放出水层,再倒出溴的苯溶液
D.  将分液后的水层蒸干获得无水FeCl3
将分液后的水层蒸干获得无水FeCl3
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.35Cl2与37Cl2互称同位素
B.白磷和红磷互为同素异形体
C.戊烷共有三种同分异构体,其沸点各不相同
D.(CH3)3CCH=CHCH3与H2加成反应后的产物名称是2,2-二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成。
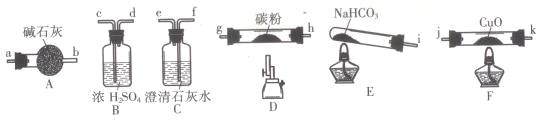
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:
i→______________________________________尾气处理(填仪器接口的字母编号)。
(2)说明CO能还原CuO的实验现象为___________________________。
(3)该实验处理尾气的方法为___________________________。
(4)若去掉B装置,可能产生的影响为___________________________。
(5)将各装置按正确的顺序连接后进行实验。当反应结束后,F处硬质玻璃管中的固体全部变为红色。
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+。
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③________。
[实验验证]该小组为验证上述猜想,分别取少量红色固体放入试管中,进行如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量稀硝酸,振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
b | 加入足量稀硫酸,振荡 | 试管内有红色固体,溶液为无色 |
[实验评价]根据上述实验,不能确定红色固体成分的实验是________(填实验编号),理由为_________(用化学方程式表示)。
[实验结论]根据上述实验结果,可知红色固体的成分为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(Ⅰ)(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)
(Ⅱ)N2O4(g)2NO2(g)
(1)反应(Ⅰ)中氧化剂是___。
(2)当温度升高时,气体颜色变深,则反应(Ⅱ)为___(填“吸热”或“放热”)反应。
(3)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=_______molL-1s-1。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___(用离子方程式表示)。
(5)向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素化合物的化学用语不正确的是
A.氟离子的结构示意图:![]()
B.H和Cl形成共价键的过程:![]()
C.铅蓄电池放电时的负极反应:Pb(s)+SO42-(aq)-2e-=PbSO4(s)
D.![]() 氧化
氧化![]() 生成单质硫:
生成单质硫:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)( )
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 用于检验溴丙烷消去产物 | 用于石油的分馏 | 用于实验室制硝基苯 | 用于实验室制备乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
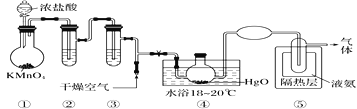
已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃,Cl2O在空气中的百分含量达到25%以上易爆炸;Cl2的沸点为-34.6 ℃;HgO+2Cl2==HgCl2+Cl2O。下列说法中不正确的是
A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com