
【题目】下列关于元素化合物的化学用语不正确的是
A.氟离子的结构示意图:![]()
B.H和Cl形成共价键的过程:![]()
C.铅蓄电池放电时的负极反应:Pb(s)+SO42-(aq)-2e-=PbSO4(s)
D.![]() 氧化
氧化![]() 生成单质硫:
生成单质硫:![]()
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I.已知:①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol,②S(s)+O2(g)=SO2(g)ΔH=-298kJ/mol,③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol。
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为_____。
Ⅱ.草酸钠滴定法测定高锰酸钾的质量分数涉及到的反应:C2O42-+2H+→H2C2O4(草酸),5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是_______。
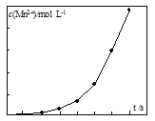
Ⅲ.KMnO4是一种常用消毒剂。
(3)KMnO4消毒机理与下列物质相似的是____(填序号)。
A.消毒酒精(75%) B. 双氧水 C. 84消毒液 D. 肥皂水 E.活性炭 F.SO2
(4)测定KMnO4产品的纯度可用标准Na2S2O3溶液滴定。
①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和___。
②取KMnO4粗产品0.7000g溶于水,并加入稀硫酸进行酸化,将所得溶液用0.1000mol/L标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积。重复步骤②、③,三次平行实验数据如表:
实验次数 | 1 | 2 | 3 |
消耗Na2SO3溶液体积/ml | 19.30 | 20.98 | 21.02 |
(已知:S2O32-被MnO4-氧化为SO42- )
计算该KMnO4产品的纯度为___。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁带能在CO2中燃烧,生成氧化镁和单质碳。请完成下列填空:
(1)碳元素形成的单质有金刚石、石墨、足球烯等。金刚石的熔点远高于足球烯的原因是_______。
(2)氧化镁的电子式为_______,CO2的结构式为______。与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为______,其1个原子中能量最高的电子有______个。
(3)一定条件下,在容积恒为2.0L的容器中,Fe和CO2发生如下反应:CO2(g)+Fe(s)![]() FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
FeO(s)+CO(g),若起始时向容器中加入1molCO2,5.0min后,容器内气体的相对平均分子量为32,则n(CO2):n(CO)之比为_______,这段时间内用CO2表示的速率v(CO2)=_______。
(4)下列说法错误的是_______。
a.当混合气体的密度不变时说明反应达到了平衡
b.混合气体的平均相对分子质量不变时说明反应达到了平衡
c.平衡后移除二氧化碳时,正反应速率一直减小直至建立新的平衡
d.平衡后缩小容器的体积,正逆反应速率不变,平衡不移动
(5)保持温度不变的情况下,待反应达到平衡后再充入一定量的二氧化碳,平衡向______移动(选填“正向”、“逆向”、或“不”),二氧化碳的转化率_____(填“增大”,“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
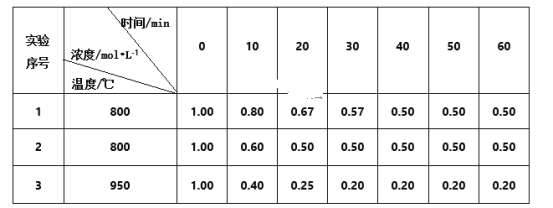
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为___mol·L-1·min-l,50min时,v正___v逆(填“<”“>”或“=”)。
(2)0~20min内,实验2比实验1的反应速率___(填“快”或“慢”),其原因可能是___。
(3)实验3比实验1的反应速率__(填“快”或“慢”),其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是( )
A. 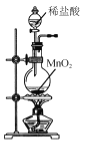 制取Cl2
制取Cl2
B. 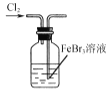 使Br-转化为Br2
使Br-转化为Br2
C.  分液,先放出水层,再倒出溴的苯溶液
分液,先放出水层,再倒出溴的苯溶液
D.  将分液后的水层蒸干获得无水FeCl3
将分液后的水层蒸干获得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外电子排布式为_______。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为_______。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属_______分子(选填“极性”“非极性”),其立体构型为____。
(3)橙红色晶体羰基钴Co2(CO)8的硬度小,不导电,可溶于多数有机溶剂。该晶体属于____晶体,三种元素电负性由大到小的顺序为(填元素符号)_______。配体CO中σ键与π键数之比是__________。
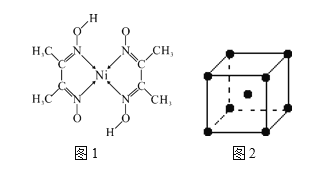
(4)元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图1所示,分子内的作用力不可能含有__________(填序号)。
A 离子键 B 共价键 C 金属键 D 配位键 E 氢键
(5)钨为熔点最高的金属,硬度极大,其晶胞结构如图2所示,已知钨的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则每个钨原子的半径r=_____________nm。(只需列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1) CH2=CHCH(CH3)2系统命名法命名为____________
(2) 4-甲基-2-乙基-1-戊烯的结构简式为__________________
(3) 支链只有一个乙基且式量最小的烷烃的结构简式为______________
(4) 某烃分子式为C6H14,若该烃不可能由炔烃与氢气加成得到则该烃的结构简式为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g,原混合气体中CO2的质量为( )
A.12.5gB.13.2gC.19.7gD.24.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1) 铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu2+的电子排布式为________。
②与NO3-互为等电子体的一种分子为________(填化学式)。
(2) 邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
① C、N、O三种元素的第一电离能由大到小的顺序为________。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为________。
③ 1 mol ![]() 中含有σ键的数目为________mol。
中含有σ键的数目为________mol。
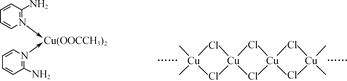
(3) 铜的某种氯化物的链状结构如图所示。该氯化物的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com