
【题目】铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1) 铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu2+的电子排布式为________。
②与NO3-互为等电子体的一种分子为________(填化学式)。
(2) 邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
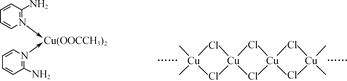
① C、N、O三种元素的第一电离能由大到小的顺序为________。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为________。
③ 1 mol ![]() 中含有σ键的数目为________mol。
中含有σ键的数目为________mol。
(3) 铜的某种氯化物的链状结构如图所示。该氯化物的化学式为________。
【答案】1s22s22p63s23p63d9或[Ar]3d9 SO3或BF3 N>O>C sp2、sp3 13 CuCl2
【解析】
(1) ①铜的原子序数为29,依据泡利原理、洪特规则书写其离子的电子排布式;
②依据等电子体原理分析作答;
(2) ①同周期中,第一电离能呈增大趋势,第IIA族和第VA族核外电子最高能级上电子为全充满和半充满结构,处于稳定状态,第一电离能较后一主族大,据此分析;
②依据杂化轨道理论分析其杂化类型;
③根据化学键的特点,两个形成共价键的原子间只能形成1个σ键,据此计算;
(3)利用均摊法分析。
(1) ①铜的原子序数为29,其电子排布式为:[Ar]3d104s1,Cu2+是铜原子失去2个电子以后的离子,其电子排布式为:1s22s22p63s23p63d9或[Ar]3d9;
②NO3-的原子个数为4,价电子数为24,从相邻或同族元素原子考虑,则与NO3-互为等电子体的分子为:SO3或BF3;
(2)①同周期中,第一电离能呈增大趋势,N的2p能级为半充满结构,处于稳定状态,第一电离能较O大,则C、N、O三种元素的第一电离能由大到小的顺序为:N>O>C;
②根据结构简式可以看出,形成4个单键的中心C原子的杂化轨道类型为sp3,羧基上的C与邻氨基吡啶中的C原子采用sp2杂化,为平面结构,故答案为sp2、sp3;
③ 1 mol ![]() ,成键原子的化学键有13mol,则含有σ键的数目为13mol;
,成键原子的化学键有13mol,则含有σ键的数目为13mol;
(3)从平面图中可以看出,一个Cu原子周围有4个Cl原子,一个Cl原子周围有2个Cu原子,则Cu与Cl的原子个数比为:1:2,即其化学式为CuCl2。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素化合物的化学用语不正确的是
A.氟离子的结构示意图:![]()
B.H和Cl形成共价键的过程:![]()
C.铅蓄电池放电时的负极反应:Pb(s)+SO42-(aq)-2e-=PbSO4(s)
D.![]() 氧化
氧化![]() 生成单质硫:
生成单质硫:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是
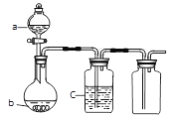
编号 | 气体 | a | b | c |
A | SO2 | 浓H2SO4 | 铜屑 | 饱和Na2SO3溶液 |
B | CO2 | 稀HNO3 | 碳酸钙 | 饱和NaHCO3 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由SiO2制备高纯度硅的工业流程如图所示:
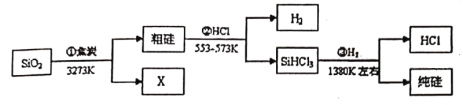
下列说法错误的是
A. SiO2与纯硅都是硬度大、熔沸点高的晶体
B. X为CO气体
C. 反应②产生的H2与反应③产生的HCl可以循环使用
D. 反应①②③均为在高温条件下的非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若![]() 为阿伏加德罗常数的值,下列说法中,正确的是
为阿伏加德罗常数的值,下列说法中,正确的是
A.1mol![]() 与
与![]() 完全反应,转移的电子总数为
完全反应,转移的电子总数为![]()
B.34g氨气中含有12![]() 个
个![]() 键
键
C.常温常压下,1mol氦气含有的原子数为![]()
D.标准状况下,![]() 和
和![]() 混合后气体分子数为
混合后气体分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是( )
A. 1.4gB. 2.2gC. 4.4gD. 在2.2g和4.4g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中![]() 含量可计算已变质的
含量可计算已变质的![]()
![]() 含
含![]() 纯度,实验装置如图
纯度,实验装置如图![]() 为弹性良好的气囊
为弹性良好的气囊![]() 。下列分析错误的是
。下列分析错误的是![]()
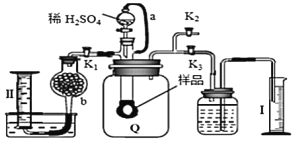
A.干燥管b中装入碱石灰
B.Q气球中产生的气体主要成份![]() 、
、![]()
C.测定气体总体积必须关闭![]() 、
、![]() ,打开
,打开![]()
D.读完气体总体积后,关闭![]() ,缓缓打开
,缓缓打开![]() ;可观察到Q气球慢慢缩小
;可观察到Q气球慢慢缩小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com