
【题目】通过测定混合气中![]() 含量可计算已变质的
含量可计算已变质的![]()
![]() 含
含![]() 纯度,实验装置如图
纯度,实验装置如图![]() 为弹性良好的气囊
为弹性良好的气囊![]() 。下列分析错误的是
。下列分析错误的是![]()
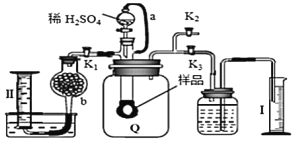
A.干燥管b中装入碱石灰
B.Q气球中产生的气体主要成份![]() 、
、![]()
C.测定气体总体积必须关闭![]() 、
、![]() ,打开
,打开![]()
D.读完气体总体积后,关闭![]() ,缓缓打开
,缓缓打开![]() ;可观察到Q气球慢慢缩小
;可观察到Q气球慢慢缩小
【答案】D
【解析】
变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:![]() ;
;![]() ,反应产生的
,反应产生的![]() 、
、![]() 使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的
使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的![]() 、
、![]() 的体积,反应停止,打开
的体积,反应停止,打开![]() ,再缓缓打开
,再缓缓打开![]() ,广口瓶内外相通,气球Q慢慢缩小,混合气体通过碱石灰吸收
,广口瓶内外相通,气球Q慢慢缩小,混合气体通过碱石灰吸收![]() ,最后量筒Ⅱ中收集的是
,最后量筒Ⅱ中收集的是![]() ,据此分析选项。
,据此分析选项。
![]() 加入氯水与样品反应在Q气球中得到二氧化碳和氧气,用碱石灰吸收二氧化碳和水蒸气,在量筒Ⅱ中排水法测氧气的量,进而计算过氧化钠的量,故A正确;
加入氯水与样品反应在Q气球中得到二氧化碳和氧气,用碱石灰吸收二氧化碳和水蒸气,在量筒Ⅱ中排水法测氧气的量,进而计算过氧化钠的量,故A正确;
B.加入酸后Q内发生反应:![]() ;
;![]() ,反应产生
,反应产生![]() 、
、![]() 气体,故B正确;
气体,故B正确;
C.反应产生的![]() 、
、![]() 使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的
使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的![]() 、
、![]() 的体积,所以滴稀
的体积,所以滴稀![]() 前必须关闭
前必须关闭![]() 、
、![]() 打开
打开![]() ,故C正确;
,故C正确;
D.读取气体总体积后关闭![]() 缓缓打开
缓缓打开![]() 还要打开
还要打开![]() ,才能观察到Q气球慢慢缩小,原因是不打开
,才能观察到Q气球慢慢缩小,原因是不打开![]() 体系是密闭的,气球体积无法减小,故D错误;
体系是密闭的,气球体积无法减小,故D错误;
故选:D。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1) 铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu2+的电子排布式为________。
②与NO3-互为等电子体的一种分子为________(填化学式)。
(2) 邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
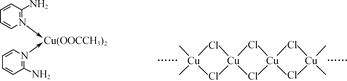
① C、N、O三种元素的第一电离能由大到小的顺序为________。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为________。
③ 1 mol ![]() 中含有σ键的数目为________mol。
中含有σ键的数目为________mol。
(3) 铜的某种氯化物的链状结构如图所示。该氯化物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡渣主要成分是SnO,还含有少量Fe、Cu、Sb、Pb、As等元素的氧化物.可用下列流程中的方法生产锡酸钠.
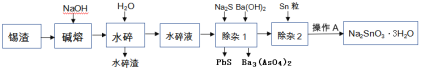
已知: ①砷酸钡难溶于水,Ksp(Ba3(AsO4)2)=10-24
②水碎液中溶质的主要成分为Na2SnO3,Na3AsO4, Na3SbO4,Na2PbO2
(1)碱熔就是在锡渣中加NaOH焙烧,SnO转变为Na2SnO3,则SnO参加反应的化学方程式为____________
(2)除杂1的目的是“除砷和铅”,加入硫化钠所发生反应的离子方程式为____________;若要使0.001mol/L的AsO43-沉淀完全(一般认为离子浓度小于10-6mol/L时即沉淀完全),需等体积加入至少____________mol/L的Ba(OH)2.
(3)除杂2中加入Sn粒的目的是____________
(4)已知Na2SnO3·3H2O可溶于水,难溶于乙醇,加热至140℃时会失去结晶水,所以最后一步从滤液中得到锡酸钠晶体的操作步骤为____________、过滤、用____________洗涤、____________.
(5)水碎渣中的铁元素主要以氧化物形式存在,回收比较容易,而铜冶炼过程中的铜渣中也有铁元素,但主要以硅酸铁的形式存在,回收方法更复杂:需先加CaO作置换剂,发生钙铁置换反应CaO+FeO·SiO2![]() CaO·SiO2+FeO,在反应过程中,加CaO的同时还需加入还原剂烟煤,则加入还原剂烟煤的作用是____________
CaO·SiO2+FeO,在反应过程中,加CaO的同时还需加入还原剂烟煤,则加入还原剂烟煤的作用是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.在硫酸工业的吸收塔中,采用浓硫酸吸收三氧化硫
B.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
C.SO2与过量氨水反应得到![]()
D.无水CoCl2吸水会变为蓝色,可用于判断变色硅胶是否吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
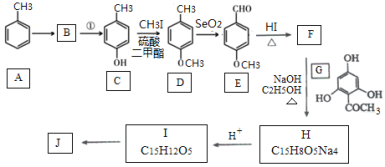
【题目】根皮素J(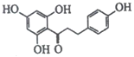 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
已知:
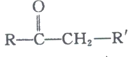 +R’’CHO
+R’’CHO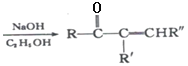 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中的官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应条件___________.
(3)写出由C生成D和由D生成E的反应类型___________、___________.
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应 ②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用锌片、铜片、发光二极管、滤纸、导线等在玻璃片制成如图所示的原电池,当滤纸用醋酸溶液润湿时,二极管发光.下列有关该电池的说法正确的是( )
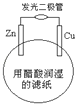
A. 铜片上的电极反应:Cu — 2e﹣ = Cu2+
B. 锌片为电池的负极
C. 外电路中电子由铜片经导线流向锌片
D. 电池工作时电能直接转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
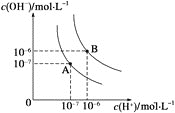
【题目】(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________mol·L-1,Kw(25 ℃)________Kw(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为_____________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定镀锌铁皮锌镀层厚度[ρ(Zn)=7.14gcm-3],某兴趣小组同学截取三块形状规则、大小相近的长方形铁皮(来自同一块镀锌铁皮),量出其长度与宽度,计算得铁片单侧面积;用稀硫酸进行定量试验,数据如下:
实验序号 | 铁片单侧面积/cm2 | 反应前质量/g | 反应后质量/g |
1 | 25.05 | 14.625 | 13.803 |
2 | 24.95 | 14.566 | 13.746 |
3 | 24.89 | 14.489 | 12.789 |
该镀锌铁皮锌镀层厚度为___cm(保留2位有效数字);写出简要计算过程。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com