
【题目】锡渣主要成分是SnO,还含有少量Fe、Cu、Sb、Pb、As等元素的氧化物.可用下列流程中的方法生产锡酸钠.
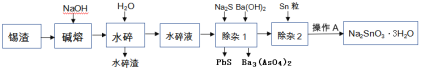
已知: ①砷酸钡难溶于水,Ksp(Ba3(AsO4)2)=10-24
②水碎液中溶质的主要成分为Na2SnO3,Na3AsO4, Na3SbO4,Na2PbO2
(1)碱熔就是在锡渣中加NaOH焙烧,SnO转变为Na2SnO3,则SnO参加反应的化学方程式为____________
(2)除杂1的目的是“除砷和铅”,加入硫化钠所发生反应的离子方程式为____________;若要使0.001mol/L的AsO43-沉淀完全(一般认为离子浓度小于10-6mol/L时即沉淀完全),需等体积加入至少____________mol/L的Ba(OH)2.
(3)除杂2中加入Sn粒的目的是____________
(4)已知Na2SnO3·3H2O可溶于水,难溶于乙醇,加热至140℃时会失去结晶水,所以最后一步从滤液中得到锡酸钠晶体的操作步骤为____________、过滤、用____________洗涤、____________.
(5)水碎渣中的铁元素主要以氧化物形式存在,回收比较容易,而铜冶炼过程中的铜渣中也有铁元素,但主要以硅酸铁的形式存在,回收方法更复杂:需先加CaO作置换剂,发生钙铁置换反应CaO+FeO·SiO2![]() CaO·SiO2+FeO,在反应过程中,加CaO的同时还需加入还原剂烟煤,则加入还原剂烟煤的作用是____________
CaO·SiO2+FeO,在反应过程中,加CaO的同时还需加入还原剂烟煤,则加入还原剂烟煤的作用是____________
【答案】2SnO+4NaOH+O2=2Na2SnO3+2H2O PbO22-+S2-+2H2O=PbS↓+4OH- 0.0017 除去SbO42-或除锑 在140℃以下加热蒸发或蒸发浓缩、冷却结晶 乙醇 低温干燥 还原FeO以减少生成物,使钙铁置换反应向正反应方向移动
【解析】
(1)碱熔就是在锡渣中加NaOH焙烧,SnO转变为Na2SnO3,在转化过程中,Sn由+2价升高到+4价,应有氧化剂参与反应,NaOH不可能作氧化剂,则必有空气中的O2参与反应,由此可写出SnO参加反应的化学方程式。
(2)除杂1的目的是“除砷和铅”,加入的Na2S与Na2PbO2反应,生成PbS,由此可写出发生反应的离子方程式;若要使0.001mol/L的AsO43-沉淀完全(一般认为离子浓度小于10-6mol/L时即沉淀完全),加入Ba(OH)2起两个作用,一个是使AsO43-完全沉淀,另一个是溶解在溶液中,使c(Ba2+)、c(AsO43-)满足Ksp(Ba3(AsO4)2)=10-24。
(3)除杂2中加入Sn粒的目的是使Na3SbO4转化为沉淀,从溶液中去除。
(4)已知Na2SnO3·3H2O可溶于水,难溶于乙醇,加热至140℃时会失去结晶水,所以最后一步从滤液中得到锡酸钠晶体的操作步骤为在140℃以下加热蒸发或蒸发浓缩、冷却结晶、过滤、为减少水洗时的溶解损失,应使用乙醇洗涤、最后再低温干燥。
(5)在反应过程中,加CaO的同时还需加入还原剂烟煤,只能还原FeO,则加入还原剂烟煤的作用是还原FeO,减少生成物,有利于平衡的正向移动。
(1)碱熔就是在锡渣中加NaOH焙烧,SnO转变为Na2SnO3,在转化过程中,Sn由+2价升高到+4价,应有氧化剂参与反应,NaOH不可能作氧化剂,则必有空气中的O2参与反应,由此可写出SnO参加反应的化学方程式为2SnO+4NaOH+O2=2Na2SnO3+2H2O。答案为:2SnO+4NaOH+O2=2Na2SnO3+2H2O;
(2)除杂1的目的是“除砷和铅”,加入的Na2S与Na2PbO2反应,生成PbS,由此可写出发生反应的离子方程式PbO22-+S2-+2H2O=PbS↓+4OH-;若要使0.001mol/L的AsO43-沉淀完全(一般认为离子浓度小于10-6mol/L时即沉淀完全),加入Ba(OH)2起两个作用,一个是使AsO43-完全沉淀,由离子方程式3Ba2++2AsO43-= Ba3(AsO4)2↓,可求出参加反应的c(Ba2+)1=![]() =0.0015mol/L;另一个是溶解在溶液中,Ba3(AsO4)2需达到沉淀溶解平衡,使c(Ba2+)2=
=0.0015mol/L;另一个是溶解在溶液中,Ba3(AsO4)2需达到沉淀溶解平衡,使c(Ba2+)2=![]() =10-4mol/L,此为混合溶液中的c(Ba2+),换算为原溶液中的浓度,则为2×10-4mol/L;从而得出c(Ba2+)= c(Ba2+)1+c(Ba2+)2(换)=0.0015mol/L+2×10-4mol/L=0.0017mol/L。答案为:PbO22-+S2-+2H2O=PbS↓+4OH-;0.0017;
=10-4mol/L,此为混合溶液中的c(Ba2+),换算为原溶液中的浓度,则为2×10-4mol/L;从而得出c(Ba2+)= c(Ba2+)1+c(Ba2+)2(换)=0.0015mol/L+2×10-4mol/L=0.0017mol/L。答案为:PbO22-+S2-+2H2O=PbS↓+4OH-;0.0017;
(3)除杂2中加入Sn粒的目的是使Na3SbO4转化为沉淀,从溶液中去除。答案为:除去SbO42-或除锑;
(4)最后一步从滤液中得到锡酸钠晶体的操作步骤为在140℃以下加热蒸发或蒸发浓缩、冷却结晶、过滤、为减少水洗时的溶解损失,应使用乙醇洗涤、最后再低温干燥。答案为:在140℃以下加热蒸发或蒸发浓缩、冷却结晶;乙醇;低温干燥;
(5)在反应过程中,加CaO的同时还需加入还原剂烟煤,只能还原FeO,则加入还原剂烟煤的作用是还原FeO,减少生成物,有利于平衡的正向移动。答案为:还原FeO以减少生成物,使钙铁置换反应向正反应方向移动。


科目:高中化学 来源: 题型:
【题目】a、b、c表示相应仪器中加入的试剂,可用如图装置制取、净化、收集的气体是
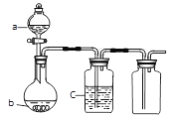
编号 | 气体 | a | b | c |
A | SO2 | 浓H2SO4 | 铜屑 | 饱和Na2SO3溶液 |
B | CO2 | 稀HNO3 | 碳酸钙 | 饱和NaHCO3 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若![]() 为阿伏加德罗常数的值,下列说法中,正确的是
为阿伏加德罗常数的值,下列说法中,正确的是
A.1mol![]() 与
与![]() 完全反应,转移的电子总数为
完全反应,转移的电子总数为![]()
B.34g氨气中含有12![]() 个
个![]() 键
键
C.常温常压下,1mol氦气含有的原子数为![]()
D.标准状况下,![]() 和
和![]() 混合后气体分子数为
混合后气体分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量是( )
A. 1.4gB. 2.2gC. 4.4gD. 在2.2g和4.4g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙是一种重要的化工原料,常见有![]() 和
和![]() 等结晶形式。某兴趣小组以废铁屑为原料制备
等结晶形式。某兴趣小组以废铁屑为原料制备![]() 的主要流程:
的主要流程:
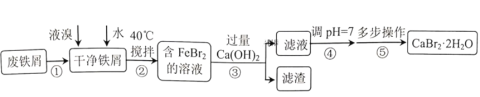
相关信息如下:
①![]() 吸湿性强。
吸湿性强。
②34℃时结晶得到![]() ,
,![]() 加热至210℃得到
加热至210℃得到![]() 。
。
请回答:
(1)步骤①的目的是去除废铁屑表面的油污,方法是________。
(2)实验室模拟海水提取溴的过程中,用苯萃取溶液中的溴,选出其正确操作并按顺序列出字母:涂凡士林→检漏→()→()→()→()→()→清洗干净。________
a.打开玻璃塞放气
b.打开旋塞放气
c.将溶液和苯转移至分液漏斗中,塞上玻璃塞
d.双手托住分液漏斗,右手压住玻璃塞,左手握住旋塞,上下颠倒振荡
e.右手压住玻璃塞,左手握住旋塞,将分液漏斗倒转振荡
f.置于铁架台铁圈上静置,打开玻璃塞,将旋塞拧开,放出下层液体
g.从下口放出溴的苯溶液
h.从上口倒出溴的苯溶液
(3)步骤④调pH=7,适宜加入的试剂是________,通过调节分液漏斗的活塞可以控制添加液体的速率。当溶液pH接近7时,滴加试剂的分液漏斗的活塞应如图中的________(填序号)所示。

(4)下列有关说法正确的是________。
A.步骤②反应控制在40℃左右,原因是防止反应过于剧烈并减少液溴挥发
B.步骤③滤渣成分只有![]() 、
、![]() 和
和![]()
C.为使![]() 快速结晶,可用冰水浴进行冷却
快速结晶,可用冰水浴进行冷却
D.步骤⑤包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作
(5)制得的![]() 可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
可以通过如下步骤测定其纯度:①称取样品质量;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤,洗涤,干燥;④称量。
若实验操作规范而测定结果偏低,其可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
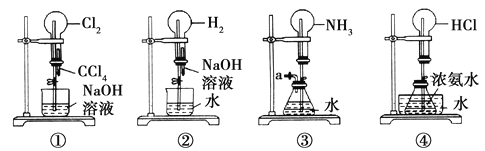
A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,并打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,并打开止水夹
C. 用鼓气装置从装置③的a处不断鼓入空气,并打开止水夹
D. 向装置④的水槽中慢慢加入足量浓硫酸,并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是( )
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.水溶液中CH3COONH4的电离:CH3COONH4![]() CH3COO-+NH4+
CH3COO-+NH4+
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中![]() 含量可计算已变质的
含量可计算已变质的![]()
![]() 含
含![]() 纯度,实验装置如图
纯度,实验装置如图![]() 为弹性良好的气囊
为弹性良好的气囊![]() 。下列分析错误的是
。下列分析错误的是![]()
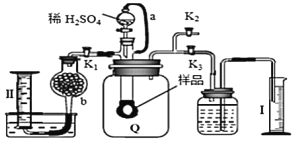
A.干燥管b中装入碱石灰
B.Q气球中产生的气体主要成份![]() 、
、![]()
C.测定气体总体积必须关闭![]() 、
、![]() ,打开
,打开![]()
D.读完气体总体积后,关闭![]() ,缓缓打开
,缓缓打开![]() ;可观察到Q气球慢慢缩小
;可观察到Q气球慢慢缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学在学习Cl2的实验室制法后,发现用加热浓盐酸与MnO2合物的方法制Cl2既浪费能源又不易控制温度,他们现欲对该实验进行改进并验证Cl2的部分性质,进行了如下探究活动。
查阅资料:KMnO4和KClO3的氧化性都比MnO2强,在不加热的条件下均可与浓盐酸发生反应,从而实现制取Cl2的目的。
(1)确定反应原理:![]() __________________
__________________![]()
(2)选择实验装置:现有如图所示的装置,可以选择其中的__________________(填序号)进行实验。

(3)装置的正确连接顺序为__________________(用小写字母序号表示)。
(4)①实验时C中所装液体是__________________。
②在制氯气前,必须进行的一项操作是__________________。
③D中所装液体是__________________。
(5)将产生的氯气通入滴有酚酞的NaOH溶液中,溶液红色退去。小组内有甲、乙两种意见。
甲:氯气溶于水后溶液显酸性,中和了NaOH,使溶液退色。
乙:氯气溶于水生成漂白性物质,使溶液退色。
某同学在退色后的溶液中逐渐加入足量的NaOH溶液,溶液一直未显红色,说明_________(填“甲”或“乙”)正确。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com