
【题目】高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I.已知:①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol,②S(s)+O2(g)=SO2(g)ΔH=-298kJ/mol,③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol。
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为_____。
Ⅱ.草酸钠滴定法测定高锰酸钾的质量分数涉及到的反应:C2O42-+2H+→H2C2O4(草酸),5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
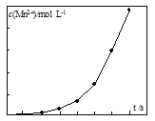
(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是_______。
Ⅲ.KMnO4是一种常用消毒剂。
(3)KMnO4消毒机理与下列物质相似的是____(填序号)。
A.消毒酒精(75%) B. 双氧水 C. 84消毒液 D. 肥皂水 E.活性炭 F.SO2
(4)测定KMnO4产品的纯度可用标准Na2S2O3溶液滴定。
①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和___。
②取KMnO4粗产品0.7000g溶于水,并加入稀硫酸进行酸化,将所得溶液用0.1000mol/L标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积。重复步骤②、③,三次平行实验数据如表:
实验次数 | 1 | 2 | 3 |
消耗Na2SO3溶液体积/ml | 19.30 | 20.98 | 21.02 |
(已知:S2O32-被MnO4-氧化为SO42- )
计算该KMnO4产品的纯度为___。(保留三位有效数字)
【答案】MnO2(s)+SO2(g)=MnSO4(s) H=-250KJ· mol -1 随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+可能对该反应有催化作用,且c(Mn2+)越大,催化效果越好 BC 500mL容量瓶、胶头滴管 75.8%
【解析】
I. ①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol ①
②S(s)+O2(g)=SO2(g) ΔH=-298kJ/mol ②
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol ③
(1)将①+③-②得,固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为MnO2(s)+SO2(g)=MnSO4(s) H=-250KJ· mol -1。
Ⅱ.(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+可能对该反应有催化作用,且c(Mn2+)越大,催化效果越好
Ⅲ.(3)KMnO4是强氧化剂,与其相似的是双氧水和84消毒液。
(4)①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和500mL容量瓶、胶头滴管。
②从数据的比较中可以看出,第1组数据为失真数据。后两组数据的平均值为21mL。
滴定过程中发生反应的离子方程式为8MnO4- + 5S2O32- + 14H+ = 10SO42- + 8Mn2+ + 7H2O
设KMnO4的质量为x
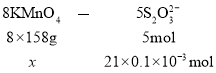
则x=![]()
该KMnO4产品的纯度为![]()
I. ①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol ①
②S(s)+O2(g)=SO2(g) ΔH=-298kJ/mol ②
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol ③
(1)将①+③-②得,固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为MnO2(s)+SO2(g)=MnSO4(s) H=-250KJ· mol -1。答案为:MnO2(s)+SO2(g)=MnSO4(s) H=-250KJ· mol -1;
Ⅱ.(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+可能对该反应有催化作用,且c(Mn2+)越大,催化效果越好。答案为:随着c(Mn2+)的不断增大,反应速率大大加快,生成的Mn2+可能对该反应有催化作用,且c(Mn2+)越大,催化效果越好;
Ⅲ.(3)KMnO4是强氧化剂,与其相似的是双氧水和84消毒液。答案为:BC;
(4)①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和500mL容量瓶、胶头滴管。答案为:500mL容量瓶、胶头滴管;
②从数据的比较中可以看出,第1组数据为失真数据。后两组数据的平均值为21mL。
滴定过程中发生反应的离子方程式为8MnO4- + 5S2O32- + 14H+ = 10SO42- + 8Mn2+ + 7H2O
设KMnO4的质量为x
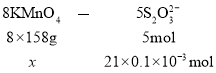
则x=![]()
该KMnO4产品的纯度为![]() =75.8%。答案为:75.8%。
=75.8%。答案为:75.8%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们认识最早的盐是食盐,![]() 尚书
尚书![]() 说命
说命![]() 记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对
记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对![]() 、
、![]() 、
、![]() 、
、![]() 四种常见的盐进行探究。回答下列问题:
四种常见的盐进行探究。回答下列问题:
⑴已知![]() 时,AgCl的溶度积为
时,AgCl的溶度积为![]() ,则AgCl在
,则AgCl在![]() 溶液中的
溶液中的![]() 为________
为________![]() 。
。
⑵![]() 时,
时,![]() 溶液的
溶液的![]() ,则关于该溶液中
,则关于该溶液中![]() 的说法正确的是________。
的说法正确的是________。
A.与m无关的定值 ![]() 与m有关的定值
与m有关的定值 ![]() 与
与![]() 有关的不定值
有关的不定值
⑶![]() 时,将
时,将![]() 溶液和
溶液和![]() 溶液各
溶液各![]() 混合,此时混合溶液的
混合,此时混合溶液的![]() ,则
,则![]() 的电离平衡常数
的电离平衡常数![]() ________
________![]() 用含n的表达式表示
用含n的表达式表示![]() 。
。
⑷将![]() 、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜
、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜![]() ,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为
,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为![]() ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到![]() 固体。所得数据显示
固体。所得数据显示![]() ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中![]() ________。
________。
⑸![]() 时,向
时,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的盐酸
的盐酸![]() ,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量
,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量![]() 纵轴
纵轴![]() 也发生变化,如图所示:
也发生变化,如图所示:
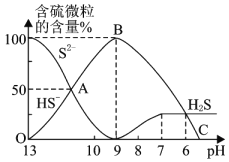
![]() 反应到A点时,溶液中的离子浓度大小的关系为________。
反应到A点时,溶液中的离子浓度大小的关系为________。
![]() 点对应的溶液中大量存在的溶质是________。
点对应的溶液中大量存在的溶质是________。
![]() 混合溶液的
混合溶液的![]() ________时,溶液中开始有
________时,溶液中开始有![]() 气体放出。
气体放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物醇A与羧酸B发生酯化反应生成分子式为C9H18O2的酯,0.5molA完全燃烧产生的气体被足量的澄清石灰水吸收生成200g沉淀,则下列说法正确的是( )
A.A的分子式为C4H8OB.B的分子式为C5H10O2
C.酯C9H18O2在稀硫酸溶液中不水解D.有机物A、B都能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”或“无影响”)。
(4)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1 NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是______,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是_____________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),简述理由: ______________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
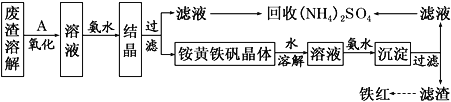
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。
(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
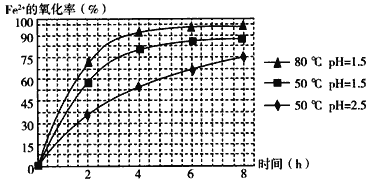
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960gmol-1,计算过程中不考虑固体损失和气体溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量___(填“高”或“低”)。
②N2(g)+O2(g)═2NO(g)的△H=___。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)2CO2(g)+N2(g)△H=akJmol﹣1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值___(选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1。如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)═CO2(g)+3H2(g)的△H1___(选填“>”“=”或“<”)0
②图中途径(Ⅱ)的条件是___,途径(Ⅰ)的反应热___(选填“>”“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H2
H2(g)+![]() O2(g)═H2O(g)△H3
O2(g)═H2O(g)△H3
△H1、△H2、△H3三者的关系式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素化合物的化学用语不正确的是
A.氟离子的结构示意图:![]()
B.H和Cl形成共价键的过程:![]()
C.铅蓄电池放电时的负极反应:Pb(s)+SO42-(aq)-2e-=PbSO4(s)
D.![]() 氧化
氧化![]() 生成单质硫:
生成单质硫:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com