
����Ŀ���Ի�����Ϊԭ�����������������ķ������������÷������Լ��ٻ�����Ⱦ�����Ϊ������ҵ�����÷���(��Fe2����Fe3���������μ�����CaO��MgO)�Ʊ��ߵ���������(Fe2O3)�ͻ���(NH4)2SO4�����������������£�
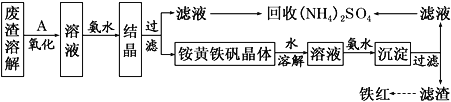
(1)�ڷ����ܽ����ʱ��Ӧѡ��________�ܽ�(����ĸ)��
A����ˮ B������������Һ C������ D������
(2) Ϊ����߷����Ľ�ȡ�ʣ��ɲ��õĴ�ʩ����Щ��_______________������д�����㣩��
(3)����A��һ������������ҵ�����ѡ��________(��ѡ��ʹ�õ��У�������Cl2��MnO2)����������_______________�����������з�����Ӧ�����ӷ���ʽΪ_________________��
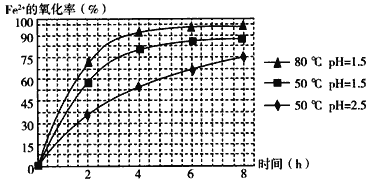
(4)������ͼ�й����ݣ�����Ϊ��ҵ����������ʱӦ���Ƶ�����(���¶ȡ�pH������ʱ��������˵��)�ǣ�______________________________________________________��
(5) 炙������п��ܻ��е�������Fe(OH)3��________��
(6) 炙������Ļ�ѧʽ�ɱ�ʾΪ(NH4)xFey(SO4)z(OH)w���仯ѧʽ��ͨ������ʵ��ⶨ��
�� ��ȡһ����������Ʒ����ϡ�������ܽ⣬��������Һת��������ƿ�����Ƴ�100.00 mL��ҺA��
�� ��ȡ25.00 mL��ҺA�����������ữ��BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����9.32 g��
�� ��ȡ25.00 mL��ҺA����������NaOH��Һ�����ȣ��ռ�����״��������448mL��ͬʱ�к��ɫ�������ɡ�
�� �����������ó������ˡ�ϴ�ӡ����գ����յù���4.80 g��
ͨ�����㣬��ȷ��炙������Ļ�ѧʽΪ___________________________������֪炙�������Ħ������Ϊ960gmol-1,��������в����ǹ�����ʧ�������ܽ���
���𰸡�D ���������顢���ȡ������ ���� ԭ���ã��ɱ��ͣ���������Ⱦ������������ 4Fe2����O2��4H��===4Fe3����2H2O ��Һ�¶ȿ�����80 �棬pH������1.5������ʱ��Ϊ4 h���� Ca(OH)2��Mg(OH)2��CaSO4 (NH4)2Fe6(SO4)4(OH)12
��������
��1������֪������̣������к���Fe2����Fe3���������μ�����CaO��MgO���ʷ����ܽ����ʱ��Ӧѡ�������ܽ�ȽϺ��ʣ���ѡD��
��2��Ϊ����߷����Ľ�ȡ�ʣ����Խ�������һ�����飬���������ı������߷�Ӧ���ʣ������Բ��ü��ȡ�����ȷ�����
��3�������ܽ������������Fe2+����ΪFe3+���ṩ��������������ֻ�п�����O2������ɫ��������ԭ���á��ɱ��͡�����Fe2+��������Ⱦ���������������ʣ������ѡ�ÿ�������Ӧ��ѧ����ʽΪ��4Fe2+��O2��4H+=4Fe3+��2H2O��
��4�����������߿ɵã���ͬʱ���ڣ�80 �桢pH=1.5ʱ��Fe2����ת������ߣ���Ӧѡ����������ȡ4Сʱ֮�����ӳ�ʱ��ת������߲��ʽ�ȡ4Сʱ�Ϻ��ʣ����Ϸ�������ҵ����������ʱӦ���Ƶ������ǣ���Һ�¶ȿ�����80 �棬pH������1.5������ʱ��Ϊ4 h���ҡ�
��5�����������Һ���Ӱ�ˮ�ᾧ�����ó�������炙����������⣬Fe3+��Mg2+��Ca2+Ҳ�������������炙������п��ܻ��е�������Fe(OH)3��Mg(OH)2��Ca(OH)2��CaSO4��
��6���ɢڵã�n��SO42-��=n��BaSO4��=9.32g��233gmol-1=0.04mol���ɢ۵ã�n��NH4+��=n��NH3��=0.448L��22.4Lmol-1=0.02mol���ɢܵã�n��Fe��=2n��Fe2O3��=2��4.8g��160gmol-1=0.06mol�����ԣ����(NH4)xFey(SO4)z(OH)w������Ϊ(NH4)xFe3x(SO4)2x(OH)w�����������ϼ۴�����Ϊ0�ã�w=6x������Ϊ(NH4)xFey(SO4)z(OH)w��Ħ������Ϊ960gmol-1�����Ի�ѧʽΪ��(NH4)2Fe6(SO4)4(OH)12



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25���£���������ĵ��볣������������й�˵������ȷ����
���� | HCOOH | HClO | H2S |
����ƽ�ⳣ��(Ka) | Ka=1.0��10-4 | Ka=2.0��10-8 | Ka1=1.3��10-7 Ka2=7.1��10-15 |
A. �� HCOONa�� HCOOH�Ļ����Һ��pH=3����c(HCOOH)/c(HCOO-)=10
B. ��ͬŨ�ȵ� HCOONa�� NaClO��Һ��������Ũ��ǰ�ߴ�
C. �κ�Ũ��NaHS��Һ���ܴ��ڣ�c(H2S)+c(H+)=c(OH��)+c(S2��)
D. �� NaClO��Һ��ͨ��H2S�����ķ�ӦΪ2C1O��+H2S===S2��+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦN2+3H2![]() 2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��( )
2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��( )
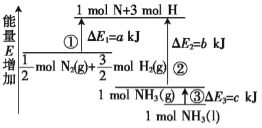
A.N2(g)+3H2(g)![]() 2NH3(l) ��H=2(a-b-c)kJ/mol
2NH3(l) ��H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)![]() 2NH3(g) ��H=2(b-a)kJ/mol
2NH3(g) ��H=2(b-a)kJ/mol
C.N2(g)+H2(g)![]() NH3(l) ��H=(b+c-a)kJ/mol
NH3(l) ��H=(b+c-a)kJ/mol
D.N2(g)+H2(g)![]() NH3(g) ��H=(a+b)kJ/mol
NH3(g) ��H=(a+b)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ������÷��У���ȷ����
A. BaCO3�ĵ��뷽��ʽ:BaCO3![]() Ba2++CO32��
Ba2++CO32��
B. ���ˮ�еμӱ����Ȼ�����Һ�õ����ɫҺ��Ļ�ѧ����ʽ:3H2O+FeCl3=3HCl+Fe(OH)3��
C. ������KI��Һ��ͨ�����(O3)�����ӷ���ʽ��2I��+O3+H2O==I2+O2+2OH��
D. ��Ba(OH)2��Һ�е��� NaHSO4��Һ��ǡ����ȫ����ʱ����Ӧ�����ӷ���ʽBa2++OH��+SO42��+H+==BaSO4��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�ֵ��͵�ǿ���������ȷֽ��������ء��������̡����������������գ�
I.��֪����MnO2(s)=Mn(s)+O2(g) ��H=+520kJ/mol����S(s)+O2(g)=SO2(g)��H=-298kJ/mol����Mn(s)+2O2(g)+S(s)=MnSO4(s) ��H=-1068kJ/mol��
��1������MnO2�Ͷ����������巴Ӧ����MnSO4������Ȼ�ѧ����ʽΪ_____��
��.�����Ƶζ����ⶨ������ص����������漰���ķ�Ӧ��C2O42-+2H+��H2C2O4�����ᣩ��5H2C2O4+2MnO4-+6H+��2Mn2++10CO2��+8H2O
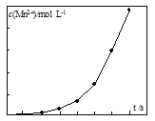
��2����һ�������������Һ���ữ�IJ�������Һ��ϣ���÷�Ӧ��Һ��Mn2+��Ũ���淴Ӧʱ��t�ı仯��ͼ��Mn2+Ũ�ȱ仯�ɻ��������Ѹ�������ԭ����_______��
��.KMnO4��һ�ֳ�����������
��3��KMnO4���������������������Ƶ���____������ţ���
A.�����ƾ���75%�� B. ˫��ˮ C. 84����Һ D. ����ˮ E.����̿ F.SO2
��4���ⶨKMnO4��Ʒ�Ĵ��ȿ��ñ�Na2S2O3��Һ�ζ���
������500ml0.1000mol/L��Na2SO3��Һ����Ҫʹ�õIJ����������ձ�����Ͳ����������___��
��ȡKMnO4�ֲ�Ʒ0.7000g����ˮ��������ϡ��������ữ����������Һ��0.1000mol/L��Na2S2O3��Һ���еζ����ζ����յ��¼ʵ������Na2S2O3��Һ��������ظ�����ڡ��ۣ�����ƽ��ʵ�����������
ʵ����� | 1 | 2 | 3 |
����Na2SO3��Һ���/ml | 19.30 | 20.98 | 21.02 |
����֪��S2O32-��MnO4-����ΪSO42- ��
�����KMnO4��Ʒ�Ĵ���Ϊ___����������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ[xCuO��yCuCl2��zH2O]��ũҵ������ɱ��������ҵ����ͭ��ۣ���Ҫ��Cu2(OH)2CO3��Fe3O4�ȣ�Ϊԭ����ȡ������ͭ���������£�
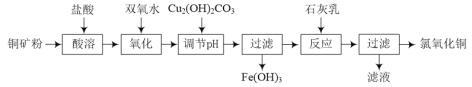
�š�����pH��������Fe(OH)3ʱ��Ӧ�����ӷ���ʽΪ______��
�Ƶ���pH��Ҫʹ������Һ��c(Cu2��)��0.022mol��L-1����c(Fe3��)��1��10��6mol��L-1����Ӧ����pH�ķ�ΧΪ______������֪Ksp[Cu(OH)2��2.2��10��20]��Ksp[Fe(OH)3��1��10��36]��
��Ϊ�ⶨ������ͭ����ɣ��ֽ�������ʵ�飺
�����ȡ0.4470 g������ͭ��������ƿ������һ����30%������ʹ������ȫ�ܽ⡣�μ�K2CrO4��Һ��ָʾ������0.1000mol��L��1 AgNO3����Һ�ζ���Һ�е�Cl�����ζ����յ�ʱ����AgNO3����Һ20.00 mL��
�����ȡ0.4470g������ͭ��������ƿ������һ��������ʹ������ȫ�ܽ⡣����Һ�м��������KI���壬��ַ�Ӧ������Һ�е������ε�����Һ����0.2000mol��L��1Na2S2O3����Һ�ζ����ζ����յ�ʱ����Na2S2O3����Һ20.00mL��
��֪��������������ķ�Ӧ���£�
2Cu2+��4I����2CuI����I2 2Na2S2O3��I2��2NaI��Na2S4O6
����֪Ag2CrO4Ϊש��ɫ�����������ζ��յ�ʱ��ʵ��������_______��
��ͨ������ȷ��������ͭ�Ļ�ѧʽ________________��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������7ƿʧȥ��ǩ���Լ�ƿ����֪����ʢװ�����л�Һ�壬�������Ҵ������ᡢ����������������֬����������Һ��������Һ����ͨ������ʵ����ȷ�����Լ�ƿ����װҺ������ơ���֪��![]() ��
��
ʵ�鲽��ͷ��� | ʵ������ |
�ٰ�7ƿҺ�����α��ΪA��B��C��D��E��F��G������ζ | ֻ��F��G����Һ��û����ζ |
�ڸ�ȡ�������Թ��м�ˮϡ�� | ֻ��C��D��E����Һ�岻�ܽ������ˮ�ϲ� |
�۷ֱ�ȡ����7��Һ�����Թ��м����Ƶ�Cu(OH)2����Һ������ | ֻ��Bʹ�����ܽ⣬F�в���ש��ɫ���� |
�ܸ�ȡC��D��E�������Թ��У���ϡNaOH��Һ������ | ֻ��C�����зֲ���������D���Թ����ŵ�������ζ |
��1����д�����б�Ŵ�����Һ�����ƣ�
A________��B________��C________��D________��E________��F________��G________��
��2��д����F�м�������Cu(OH)2����Һ�����ȵĻ�ѧ����ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ��ϡ��![]() �Ĵ��ᣬ��ά���¶Ȳ��䣬����ϡ��������������ǣ� ��
�Ĵ��ᣬ��ά���¶Ȳ��䣬����ϡ��������������ǣ� ��
A.![]() �����ʵ���Ũ��B.
�����ʵ���Ũ��B.![]() �����ʵ���Ũ��
�����ʵ���Ũ��
C.H+�����ʵ���Ũ��D.![]() ��H+�����ʵ���
��H+�����ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�ҽ����������Ƶ��������ܺϽ���������˵���̼���ܽṹ�Ŀɿ��Ʊ����⡣
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ_______������̼���ܿɿ���ʯīϩ��һ������������ɵĿ���Բ���壬��̼ԭ�ӵ��ӻ���ʽΪ_______��
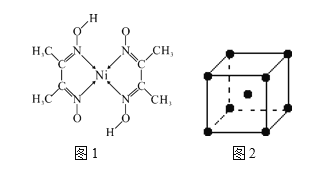
��2�����ṹ�����ܿ��������½���ȩ��HCHO����ȫ����������֪��ȩ��ԭ�Ӿ������ȶ��ṹ����ȩ������_______���ӣ�ѡ�������������Ǽ��������������幹��Ϊ____��
��3���Ⱥ�ɫ�����ʻ���Co2(CO)8��Ӳ��С�������磬�����ڶ����л��ܼ����þ�������____���壬����Ԫ�ص縺���ɴ�С��˳��Ϊ����Ԫ�ط��ţ�_______������CO��������������֮����__________��
��4��Ԫ�������ܡ���������ϵԪ�أ����ʾ��������ԡ�ij����������ṹ��ͼ1��ʾ�������ڵ������������ܺ���__________������ţ���
A ���Ӽ� B ���ۼ� C ������ D ��λ�� E ���
��5����Ϊ�۵���ߵĽ�����Ӳ�ȼ����侧���ṹ��ͼ2��ʾ����֪�ٵ��ܶ�Ϊ�� g��cm-3�������ӵ�������ֵΪNA����ÿ����ԭ�ӵİ뾶r��_____________nm����ֻ���г�����ʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com