
【题目】化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应的热化学方程式是( )
2NH3的能量变化如图所示,该反应的热化学方程式是( )
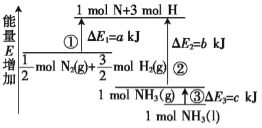
A.N2(g)+3H2(g)![]() 2NH3(l) △H=2(a-b-c)kJ/mol
2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)![]() 2NH3(g) △H=2(b-a)kJ/mol
2NH3(g) △H=2(b-a)kJ/mol
C.N2(g)+H2(g)![]() NH3(l) △H=(b+c-a)kJ/mol
NH3(l) △H=(b+c-a)kJ/mol
D.N2(g)+H2(g)![]() NH3(g) △H=(a+b)kJ/mol
NH3(g) △H=(a+b)kJ/mol
【答案】A
【解析】
根据反应物的能量与生成物的能力差计算反应热,结合物质活化能计算相应反应的反应热及反应热数值大小。
由图可以看出,△E为反应的活化能,反应热等于反应物的活化能减生成物的活化能,所以![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) △H=(a-b) kJ/mol,则N2(g)+3H2(g)
H2(g)=NH3(g) △H=(a-b) kJ/mol,则N2(g)+3H2(g)![]() 2NH3(g) △H=-2(b-a) kJ/mol,而1 mol的NH3(g)转化为1 mol的NH3(l)放出的热量为c kJ,则2 mol的NH3(g)转化为2 mol的NH3(l)放出的热量为2c kJ,所以反应N2(g)+3H2(g)
2NH3(g) △H=-2(b-a) kJ/mol,而1 mol的NH3(g)转化为1 mol的NH3(l)放出的热量为c kJ,则2 mol的NH3(g)转化为2 mol的NH3(l)放出的热量为2c kJ,所以反应N2(g)+3H2(g)![]() 2NH3(l)的反应热△H=2(a-b-c) kJ/mol,A正确,故合理选项是A。
2NH3(l)的反应热△H=2(a-b-c) kJ/mol,A正确,故合理选项是A。


科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
A.加催化剂B.升高温度C.充入CO2D.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们认识最早的盐是食盐,![]() 尚书
尚书![]() 说命
说命![]() 记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对
记载:“若作和羹,尔惟盐梅”,说明劳动人民在商代就已经知道用盐配制美味的羹汤。而现代化学定义的盐,具有更广范围和更深的涵义,探索它们的奥秘可以使我们更科学的利用它们。今对![]() 、
、![]() 、
、![]() 、
、![]() 四种常见的盐进行探究。回答下列问题:
四种常见的盐进行探究。回答下列问题:
⑴已知![]() 时,AgCl的溶度积为
时,AgCl的溶度积为![]() ,则AgCl在
,则AgCl在![]() 溶液中的
溶液中的![]() 为________
为________![]() 。
。
⑵![]() 时,
时,![]() 溶液的
溶液的![]() ,则关于该溶液中
,则关于该溶液中![]() 的说法正确的是________。
的说法正确的是________。
A.与m无关的定值 ![]() 与m有关的定值
与m有关的定值 ![]() 与
与![]() 有关的不定值
有关的不定值
⑶![]() 时,将
时,将![]() 溶液和
溶液和![]() 溶液各
溶液各![]() 混合,此时混合溶液的
混合,此时混合溶液的![]() ,则
,则![]() 的电离平衡常数
的电离平衡常数![]() ________
________![]() 用含n的表达式表示
用含n的表达式表示![]() 。
。
⑷将![]() 、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜
、生石灰和水按一定比例混合可得杀菌剂波尔多液,其有效成分为难溶的碱式硫酸铜![]() ,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为
,为测定其中x与y的比值,进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸为![]() ,另一份高温灼烧后只得到
,另一份高温灼烧后只得到![]() 固体。所得数据显示
固体。所得数据显示![]() ,则该碱式硫酸铜的化学式中
,则该碱式硫酸铜的化学式中![]() ________。
________。
⑸![]() 时,向
时,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的盐酸
的盐酸![]() ,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量
,溶液的pH逐渐降低,此时溶液中含硫元素的微粒物质的量浓度的百分含量![]() 纵轴
纵轴![]() 也发生变化,如图所示:
也发生变化,如图所示:
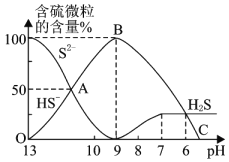
![]() 反应到A点时,溶液中的离子浓度大小的关系为________。
反应到A点时,溶液中的离子浓度大小的关系为________。
![]() 点对应的溶液中大量存在的溶质是________。
点对应的溶液中大量存在的溶质是________。
![]() 混合溶液的
混合溶液的![]() ________时,溶液中开始有
________时,溶液中开始有![]() 气体放出。
气体放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
B.硅单质可用作光导纤维的原料
C.CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物醇A与羧酸B发生酯化反应生成分子式为C9H18O2的酯,0.5molA完全燃烧产生的气体被足量的澄清石灰水吸收生成200g沉淀,则下列说法正确的是( )
A.A的分子式为C4H8OB.B的分子式为C5H10O2
C.酯C9H18O2在稀硫酸溶液中不水解D.有机物A、B都能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
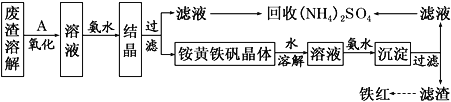
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。
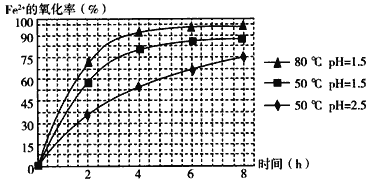
(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960gmol-1,计算过程中不考虑固体损失和气体溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中可能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO![]()
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Cu2+、Mg2+、NO![]() 、SO
、SO![]()
C.0.1mol·L-1FeCl3溶液中:Fe2+、NH![]() 、SCN-、SO
、SCN-、SO![]()
D.无色溶液中:Cu2+、Al3+、![]() 、Cl-
、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com