
【题目】25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO
【答案】D
【解析】
A. 利用甲酸的电离平衡常数将c(HCOOH)/c(HCOO-)![]() ,据此分析作答;
,据此分析作答;
B.依据电荷守恒式列出HCOONa溶液和NaClO溶液中的离子浓度关系,电离常数越小,其对应盐的水解程度越大,结合表格判断;
C. 溶液中离子浓度遵循质子守恒定律;
D. NaClO具有强氧化性,会与H2S发生氧化还原反应。
A. 在溶液中,HCOOH的电离平衡常数Ka = ![]() ,则pH=3的HCOONa和 HCOOH的混合溶液中,c(HCOOH)/c(HCOO-)
,则pH=3的HCOONa和 HCOOH的混合溶液中,c(HCOOH)/c(HCOO-)![]() =
= ![]() = 10,故A项正确;
= 10,故A项正确;
B. HCOONa溶液中的电荷守恒式为:c(Na+) + c(H+) = c(OH-)+ c(HCOO-),溶液中总离子浓度为2 [c(Na+) + c(H+)],同理可得,NaClO溶液中的总离子浓度为2 [c(Na+) + c(H+)],由表格数据可知,HCOOH比HClO易电离,相同浓度的 HCOONa和 NaClO溶液中,ClO-水解程度比HCOO-的水解程度大,说明NaClO溶液溶液中c(OH-)大,c(H+)小,即相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大,故B项正确;
C. 任何浓度的NaHS溶液遵循质子守恒规律,总存在:c(H2S)+c(H+)=c(OH-)+c(S2-),故C项正确;
D. NaClO具有强氧化性,则向NaClO溶液中通入H2S发生的反应是氧化还原反应,故D项错误;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示,气缸体积一定,内部被活塞隔成ABC三部分,活塞可以自由移动。常温下,A中充入4g氢气, B中充入16g氧气,C中充入4g氦气。
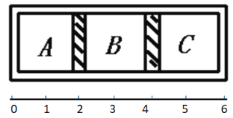
(1)当活塞不移动时,求A、B、C三部分体积比VA:VB:VC。____
(2)拿走A和B之间的活塞,让氢气和氧气充分混合用电火花点燃,恢复到原来的温度,通过计算,判断活塞停止的位置。(用线上数字表示)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(1)用单线桥法表示该反应电子转移的方向和数目:___________。
(2)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是___________,转移电子的数目是_____________。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1∶1的混合液,反应的化学方程式是 _________________________ 。
(4)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S是一种二元弱酸,回答以下问题:
(1)0.1mol/L NaHS溶液显碱性,则c(S2-)___________c(H2S)(填“大于” ,“小于” 或“等于” ) 。
(2)常温下,向0.2 mol/L的H2S溶液中逐滴滴入0.2 mol/L NaOH溶液至中性,此时溶液中以下所示关系一定正确的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)=c(HS-)+2c(S2-)
C.c(Na+) > c(HS-)+c(S2-)+c(H2S)
D.c(H2S) > c(S2-)
(3)已知常温下,CaS饱和溶液中存在平衡:CaS(s)![]() Ca2+(aq)+S2-(aq) ΔH>0。
Ca2+(aq)+S2-(aq) ΔH>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是______________________________________________(用文字和离子方程式说明)。
(4)若向CaS悬浊液中加入Cu(NO3)2溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:

(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
A.CO的转化率将增大 B.达到新平衡时的反应热ΔH > —Q
C.气体的密度将不变 D.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g)
2NH3(g)
①达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
A.6 molH2 + 4 molN2
B.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
C.3 molH2+ 1 molN2 + 2 mol NH3
② 若是在恒温恒容的容器中反应,达到平衡时NH3的浓度为c1 mol·L-1,则c________c1(填“<”“>”或“=”),原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第20届中国国际工业博览会上,华东师范大学带来一种“锌+碘”新型安全动力电池,亮相工博会高校展区。“锌+碘”新型安全动力电池有望取代目前广泛使用的“铅蓄电池”、“锂电池”等,已知该电池的工作原理如图所示。下列有关说法错误的是

A. 该电池安全性高,且对环境友好
B. 正极反应式为I3-+2e-=3I-,电极a附近显红色
C. 电子的移动方向为“Zn→电极a→电极b→石墨毡”
D. “回流通道”可以减缓电池两室的压差,避免电池受损
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有相同氧原子数的二氧化硫和三氧化硫,物质的量之比是___,质量之比是___。把4mol/LCuSO4和2mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和),求混合溶液中C(CuSO4)=_____mol/L,C(SO42-)=___mol/L。将10毫升2mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为____毫升。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,a g气体A与b g气体B的分子数相同,下列说法中不正确的是( )
A. A与B两种气体的相对分子质量之比为a∶b
B. 在同温同压的条件下,A与B两种气体的密度之比为b∶a
C. 同质量的A、B两种气体的分子个数之比为b∶a
D. 相同条件下,同体积A气体与B气体的质量之比为a∶b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
①标准状况下,11.2 L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③标准状况下,22.4 L H2O中分子数为NA
④32 g O2和O3混合气体中含有原子数为2NA
A.①②③④B.①②④C.①③④D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com