
【题目】现有7瓶失去标签的试剂瓶,已知它们盛装的是有机液体,可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液、蔗糖溶液。现通过如下实验来确定各试剂瓶中所装液体的名称。已知:![]() 。
。
实验步骤和方法 | 实验现象 |
①把7瓶液体依次标号为A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
③分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀NaOH溶液并加热 | 只有C中仍有分层现象,且在D的试管中闻到特殊香味 |
(1)试写出下列标号代表的液体名称:
A________,B________,C________,D________,E________,F________,G________。
(2)写出在F中加入新制Cu(OH)2悬浊液并加热的化学方程式:________________。
【答案】乙醇 乙酸 苯 乙酸乙酯 油脂 葡萄糖溶液 蔗糖溶液 ![]()
【解析】
本题通过实验现象与性质的关系来推断有机物。7种物质中只有葡萄糖溶液和蔗糖溶液无气味;苯、乙酸乙酯、油脂不溶于水且密度比水小;乙酸呈酸性,能与Cu(OH)2发生中和反应,葡萄糖具有还原性,能与新制的Cu(OH)2在加热条件下反应生成砖红色的Cu2O沉淀;乙酸乙酯、油脂均在稀NaOH溶液中发生水解,而不再有分层现象,乙酸乙酯的水解产物之一乙醇有特殊香味,苯不溶于水且密度比水小,不与NaOH反应。据此进行分析。
(1)据分析可知:A为乙醇,B为乙酸,C为苯,D为乙酸乙酯,E为油脂,F为葡萄糖,G为蔗糖。故答案为:乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖、蔗糖;
(2)葡萄糖与新制氢氧化铜悬浊液在加热条件下发生反应生成葡萄糖酸、砖红色沉淀和水,反应方程式为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物醇A与羧酸B发生酯化反应生成分子式为C9H18O2的酯,0.5molA完全燃烧产生的气体被足量的澄清石灰水吸收生成200g沉淀,则下列说法正确的是( )
A.A的分子式为C4H8OB.B的分子式为C5H10O2
C.酯C9H18O2在稀硫酸溶液中不水解D.有机物A、B都能与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
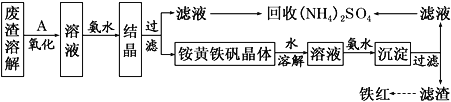
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。
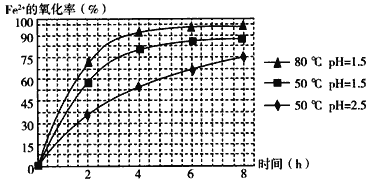
(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960gmol-1,计算过程中不考虑固体损失和气体溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究![]() 、
、![]() 与盐酸(浓度为
与盐酸(浓度为![]() )反应过程中的热效应,实验测得的数据如表所示:
)反应过程中的热效应,实验测得的数据如表所示:
序号 | 35mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5g | 20.0 | 18.5 |
② | 水 | 3.2g | 20.0 | 24.3 |
③ | 盐酸 | 2.5g | 20.0 | 16.2 |
④ | 盐酸 | 3.2g | 20.0 | 25.1 |
由此得出的结论正确的是( )
A.![]() 固体与盐酸的反应是吸热反应
固体与盐酸的反应是吸热反应
B.![]() 固体与盐酸的反应是放热反应
固体与盐酸的反应是放热反应
C.20.0℃时,含3.2g![]() 的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g![]() 的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量___(填“高”或“低”)。
②N2(g)+O2(g)═2NO(g)的△H=___。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)2CO2(g)+N2(g)△H=akJmol﹣1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值___(选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1。如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)═CO2(g)+3H2(g)的△H1___(选填“>”“=”或“<”)0
②图中途径(Ⅱ)的条件是___,途径(Ⅰ)的反应热___(选填“>”“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H2
H2(g)+![]() O2(g)═H2O(g)△H3
O2(g)═H2O(g)△H3
△H1、△H2、△H3三者的关系式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中可能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO![]()
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Cu2+、Mg2+、NO![]() 、SO
、SO![]()
C.0.1mol·L-1FeCl3溶液中:Fe2+、NH![]() 、SCN-、SO
、SCN-、SO![]()
D.无色溶液中:Cu2+、Al3+、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列氧化还原反应中转移电子数的判断,不正确的是 ( )
A.H2S+H2SO4(浓)=S↓+SO2↑+2H2O:6e-
B.3Cl2+6KOH![]() 5KCl+KClO3+3H2O:5e-
5KCl+KClO3+3H2O:5e-
C.2Na2O2+2H2O=4NaOH+O2↑:2e-
D.2H2S+SO2=3S+2H2O:4e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com