
【题目】用蒸馏水逐渐稀释![]() 的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是( )
的醋酸,若维持温度不变,则在稀释过程中逐渐增大的是( )
A.![]() 的物质的量浓度B.
的物质的量浓度B.![]() 的物质的量浓度
的物质的量浓度
C.H+的物质的量浓度D.![]() 和H+的物质的量
和H+的物质的量
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上利用废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:
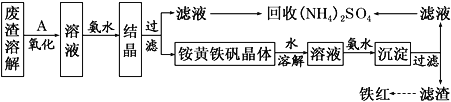
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2) 为了提高废渣的浸取率,可采用的措施有哪些?_______________(至少写出两点)。
(3)物质A是一种氧化剂,工业上最好选用________(供选择使用的有:空气、Cl2、MnO2),其理由是_______________。氧化过程中发生反应的离子方程式为_________________。
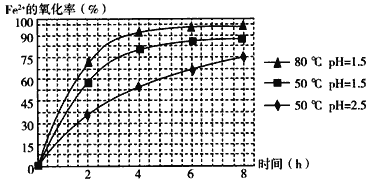
(4)根据如图有关数据,你认为工业上氧化操作时应控制的条件(从温度、pH和氧化时间三方面说明)是:______________________________________________________。
(5) 铵黄铁矾中可能混有的杂质有Fe(OH)3、________。
(6) 铵黄铁矾的化学式可表示为(NH4)xFey(SO4)z(OH)w,其化学式可通过下列实验测定:
① 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
② 量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③ 量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体448mL,同时有红褐色沉淀生成。
④ 将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算,可确定铵黄铁矾的化学式为___________________________。(已知铵黄铁矾的摩尔质量为960gmol-1,计算过程中不考虑固体损失和气体溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究![]() 、
、![]() 与盐酸(浓度为
与盐酸(浓度为![]() )反应过程中的热效应,实验测得的数据如表所示:
)反应过程中的热效应,实验测得的数据如表所示:
序号 | 35mL试剂 | 固体 | 混合前温度/℃ | 混合后温度/℃ |
① | 水 | 2.5g | 20.0 | 18.5 |
② | 水 | 3.2g | 20.0 | 24.3 |
③ | 盐酸 | 2.5g | 20.0 | 16.2 |
④ | 盐酸 | 3.2g | 20.0 | 25.1 |
由此得出的结论正确的是( )
A.![]() 固体与盐酸的反应是吸热反应
固体与盐酸的反应是吸热反应
B.![]() 固体与盐酸的反应是放热反应
固体与盐酸的反应是放热反应
C.20.0℃时,含3.2g![]() 的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g![]() 的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
的饱和溶液和35mL盐酸混合后的温度将低于16.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量___(填“高”或“低”)。
②N2(g)+O2(g)═2NO(g)的△H=___。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)2CO2(g)+N2(g)△H=akJmol﹣1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值___(选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1。如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)═CO2(g)+3H2(g)的△H1___(选填“>”“=”或“<”)0
②图中途径(Ⅱ)的条件是___,途径(Ⅰ)的反应热___(选填“>”“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H2
H2(g)+![]() O2(g)═H2O(g)△H3
O2(g)═H2O(g)△H3
△H1、△H2、△H3三者的关系式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为______________。
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是______________。
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明黑色沉淀具有_________性。 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:__________。
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全,则混合物中Cu2S 的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中可能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO![]()
B.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Cu2+、Mg2+、NO![]() 、SO
、SO![]()
C.0.1mol·L-1FeCl3溶液中:Fe2+、NH![]() 、SCN-、SO
、SCN-、SO![]()
D.无色溶液中:Cu2+、Al3+、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以黄铜矿为原料,采用火法治铜。其中间过程的一个反应的化学方程式为2Cu2O+Cu2S![]() 6Cu+SO2↑,对于该反应下列说法正确的是
6Cu+SO2↑,对于该反应下列说法正确的是
A.氧化产物是Cu
B.还原剂是![]()
C.生成1molCu转移的电子数为2mol
D.![]() 既是氧化剂也是还原剂
既是氧化剂也是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数Ka | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,电离平衡常数Ka__(填“增大”、“减小”或“不变”),H2CO3的一级电离平衡常数表达式为Ka1 =___。
(2)下列四种离子结合H+能力最强的是__(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)HClO与Na2CO3溶液反应的离子方程式___。
(4)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=5,则溶液中c(CH3COO-)-c(Na+)=___mol·L-1(填近似值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com