
����Ŀ��ij��ȤС���ͭ��Ũ���ᷴӦ�����ĺ�ɫ���������ܺ���CuO��CuS��Cu2S������CuS�� Cu2S������ϡ���ᡢϡ���ᣩ����̽����ʵ�鲽�����£�
������ͭ˿����Ũ���ᣬ���ȣ�
������������ɫ����������ʱ�����ͭ˿��ֹͣ���ȣ�
����ȴ�ӷ�Ӧ��Ļ�����з������ɫ������ϴ�������ﱸ�á�
�ش��������⣺
��1��������������Ļ�ѧʽΪ______________��
��2������ Cu2+��Һ�еμ�K4[Fe(CN)6]��Һ���ܲ������ɫ�������ֽ�������ɫ��������ϡ�����У�������Ժ��ٵμ�K4[Fe(CN)6]��Һ��δ�����ɫ�������ɴ����ý�����______________��
��3��Ϊ֤����ɫ��������ͭ�������������ʵ�飺
װ�� | ���� | ���ۼ����� |
| ��A�Թ��к�ɫ�������ܽ� | a�������˵����ɫ��������_________�ԡ� |
��4��CuS�����������ȵ�Ũ���ᣬ�����й�ƽ���ƶ�ԭ�����Խ��ͣ�__________��
��5��Ϊ�ⶨ��ɫ������Cu2S �İٷֺ�����ȡ0.2g ��������ú�ɫ��������������Һ���� 40.0mL 0.075mol/L KMnO4��Һ������������Ӧ���£�
8MnO4��+5Cu2S+44H+�T10Cu2++5SO2��+8Mn2++22H2O
6MnO4��+5CuS+28H+�T5Cu2++5SO2��+6Mn2++14H2O
��Ӧ�������Һ���Ͼ�SO2�������ĸ��������Һǡ����35.0mL 0.1mol/L (NH4)2Fe(SO4)2��Һ��Ӧ��ȫ����������Cu2S ����������Ϊ____________________��
���𰸡�SO2 ��ɫ�����в�����CuO ��ԭ�� NO2+SO2+Ba2++H2O�TBaSO4��+NO��+2H+ CuS�����ܽ�ƽ��CuS��s��Cu2+��aq��+S2����aq�����ȵ�Ũ���ὫS2��������ʹS2��Ũ�ȼ�С���ٽ�����ƽ���������ƶ���ʹCuS�ܽ� 40%
��������
��1������ͭ��Ũ���ᷴӦ���ɶ�������������н��
��2������������Ϣ�м���ͭ���ӵķ����Ԣڽ��з�����Ȼ��ó���ȷ���ۣ�
��3��a������ɫ����Ϊ����������˵��ϡ���ᱻ��ԭ����һ����������ɫ������л�ԭ�ԣ�
b�����ݷ�Ӧ����ۿ�֪��ɫ������ϡ���ᷴӦ�����˶�������֤����ɫ�����к�����Ԫ�أ�������������������Ļ�������ܹ����Ȼ�����Ӧ�������ᱵ�������ݴ�д����Ӧ�����ӷ���ʽ��
��4��CuS����Һ�д��ڳ����ܽ�ƽ�⣬����ƽ���ƶ�������
��5�����ݵζ�ʵ�����ݼ���ʣ�����������ʵ������õ�������ͭ����ͭ��Ӧ�ĸ���������ʵ��������ݷ�Ӧ�����ӷ���ʽ��ʽ����õ���
��1��Cu��Ũ���ᷴӦ��������ͭ�����������ˮ����ӦΪCu+2H2SO4��Ũ��![]() CuSO4+2SO2��+2H2O������������������SO2���ʴ�ΪSO2��
CuSO4+2SO2��+2H2O������������������SO2���ʴ�ΪSO2��
��2������Һ�еμ�K4[Fe(CN)6]��Һ�����������ɫ������֤����Cu2+�����ݢڽ���ɫ��������ϡ�����У�һ��ʱ��μ� K4[Fe(CN)6]��Һ��δ�����ɫ������֪����ɫ������һ������CuO���ʴ�Ϊ��ɫ�����в�����CuO��
��3��a��A�Թ����Ϸ����ֺ���ɫ���壬˵����Ӧ����һ���������ɣ�֤���˺�ɫ������л�ԭ�ԣ��ڷ�Ӧ�б��������ʴ�Ϊ��ԭ�ԣ�
b�����ݷ�Ӧ�����B�Թ��г��ְ�ɫ������֪����ɫ����Ϊ���ᱵ��˵����ɫ�����к�����Ԫ�أ�������Ӧ�����ӷ���ʽΪ��NO2+SO2+Ba2++H2O�TBaSO4��+NO��+2H+���ʴ�ΪNO2+SO2+Ba2++H2O�TBaSO4��+NO��+2H+��
��4��CuS������ˮ����ˮ��Һ�л��к�������CuS�ܽ⣬��Һ�д��ڳ����ܽ�ƽ�⣬CuS��s��![]() Cu2+��aq��+S2����aq�����ȵ�Ũ���ὫS2��������ʹS2��Ũ�ȼ�С���ٽ�����ƽ���������ƶ���ʹCuS�ܽ⣻�ʴ�ΪCuS�����ܽ�ƽ��CuS��s��
Cu2+��aq��+S2����aq�����ȵ�Ũ���ὫS2��������ʹS2��Ũ�ȼ�С���ٽ�����ƽ���������ƶ���ʹCuS�ܽ⣻�ʴ�ΪCuS�����ܽ�ƽ��CuS��s��![]() Cu2+��aq��+S2����aq�����ȵ�Ũ���ὫS2��������ʹS2��Ũ�ȼ�С���ٽ�����ƽ���������ƶ���ʹCuS�ܽ⣻
Cu2+��aq��+S2����aq�����ȵ�Ũ���ὫS2��������ʹS2��Ũ�ȼ�С���ٽ�����ƽ���������ƶ���ʹCuS�ܽ⣻
��5�������ķ�ӦΪ��
8MnO4��+5Cu2S+44H+�T10Cu2++5SO2��+8Mn2++22H2O
6MnO4��+5CuS+28H+�T5Cu2++5SO2��+6Mn2++14H2O
MnO4��+5Fe2++8H+�TMn2++5Fe3++4H2O
��Cu2S��CuS�����ʵ����ֱ�Ϊx��y��
��Cu2S��CuS��Ӧ��ʣ��KMnO4�����ʵ�����0.035L��0.1mol/L��![]() =0.0007mol��
=0.0007mol��
160x+96y=0.2
![]() =0.04��0.075��0.0007
=0.04��0.075��0.0007
���x=0.0005mol��
Cu2S������������![]() ��100%=40%��
��100%=40%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��������ܱ������о�������Ӧ��C(s)��2H2O(g) ![]() CO2(g)��2H2(g)����H��0���й�ʵ���������±���ʾ��
CO2(g)��2H2(g)����H��0���й�ʵ���������±���ʾ��
���� | �ݻ�/L | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ƽ�ⳣ�� | |
C(s) | H2O(g) | H2(g) | |||||
�� | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
�� | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
����˵����ȷ����(����)
A.T1<T2B.�������У�����Ӧ���е�1.5 minʱ��n(H2O)��1.4 mol
C.���������ܶ�ʼ�ձ��ֲ���D.K2��1.35
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ[xCuO��yCuCl2��zH2O]��ũҵ������ɱ��������ҵ����ͭ��ۣ���Ҫ��Cu2(OH)2CO3��Fe3O4�ȣ�Ϊԭ����ȡ������ͭ���������£�
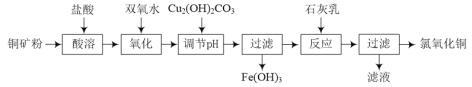
�š�����pH��������Fe(OH)3ʱ��Ӧ�����ӷ���ʽΪ______��
�Ƶ���pH��Ҫʹ������Һ��c(Cu2��)��0.022mol��L-1����c(Fe3��)��1��10��6mol��L-1����Ӧ����pH�ķ�ΧΪ______������֪Ksp[Cu(OH)2��2.2��10��20]��Ksp[Fe(OH)3��1��10��36]��
��Ϊ�ⶨ������ͭ����ɣ��ֽ�������ʵ�飺
�����ȡ0.4470 g������ͭ��������ƿ������һ����30%������ʹ������ȫ�ܽ⡣�μ�K2CrO4��Һ��ָʾ������0.1000mol��L��1 AgNO3����Һ�ζ���Һ�е�Cl�����ζ����յ�ʱ����AgNO3����Һ20.00 mL��
�����ȡ0.4470g������ͭ��������ƿ������һ��������ʹ������ȫ�ܽ⡣����Һ�м��������KI���壬��ַ�Ӧ������Һ�е������ε�����Һ����0.2000mol��L��1Na2S2O3����Һ�ζ����ζ����յ�ʱ����Na2S2O3����Һ20.00mL��
��֪��������������ķ�Ӧ���£�
2Cu2+��4I����2CuI����I2 2Na2S2O3��I2��2NaI��Na2S4O6
����֪Ag2CrO4Ϊש��ɫ�����������ζ��յ�ʱ��ʵ��������_______��
��ͨ������ȷ��������ͭ�Ļ�ѧʽ________________��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ж��֣���Ҫ��ش��������⣺
(1)������ʽΪC4H10O����������Ʒ�Ӧ�ų�H2���л���������________�֡�
(2)�뻯����C7H10O2��Ϊͬ���칹������ʲ�����Ϊ________(�����)��
A.�� B.ȩ C.���� D.��
(3)��![]() ������ͬ�����ŵ�ͬ���칹��Ľṹ��ʽΪ______________(д��һ�ּ���)��
������ͬ�����ŵ�ͬ���칹��Ľṹ��ʽΪ______________(д��һ�ּ���)��
(4)��������(![]() )�ж��������ͬ���칹�塣��������FeCl3��Һ������ɫ��Ӧ���ұ�������2��һ����ȡ�����ͬ���칹����________(д���������ֵĽṹ��ʽ)��
)�ж��������ͬ���칹�塣��������FeCl3��Һ������ɫ��Ӧ���ұ�������2��һ����ȡ�����ͬ���칹����________(д���������ֵĽṹ��ʽ)��
(5)����ʽΪC5H10��ϩ������(������˳���칹)__________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ��ϡ��![]() �Ĵ��ᣬ��ά���¶Ȳ��䣬����ϡ��������������ǣ� ��
�Ĵ��ᣬ��ά���¶Ȳ��䣬����ϡ��������������ǣ� ��
A.![]() �����ʵ���Ũ��B.
�����ʵ���Ũ��B.![]() �����ʵ���Ũ��
�����ʵ���Ũ��
C.H+�����ʵ���Ũ��D.![]() ��H+�����ʵ���
��H+�����ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������硢��ѧ���������ά�����ⷢ�������Ա����(��Ҫ�ɷ�ΪBaCO3�� ����SiO2��Fe2+��Mg2+������)Ϊԭ���Ʊ����������������£�
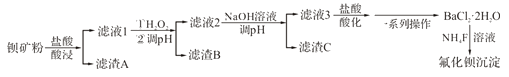
��֪��������Fe3+��Mg2+��ȫ������pH�ֱ���3.4��12.4��
(1)����A�Ļ�ѧʽΪ_________________��
(2)��Һ1��H2O2�����Ĺ�������Ҫ��Ӧ�����ӷ���ʽΪ__________________��
(3)��20%NaOH��Һ����pH=12.5���õ�����C����Ҫ�ɷ���___________��
(4)��Һ3���������ữ���پ�__________����ȴ�ᾧ��__________��ϴ�ӡ���ո����һϵ�в�����õ�BaCl2��2H2O��
(5)�����£���BaCl2��2H2O���Ƴ�0.2mol��L-1ˮ��Һ���Ũ�ȵķ������Һ��Ӧ���ɵõ��Ȼ��������� ��֪Ksp(BaF2)=1.84��l0-7������������ȫ����ʱ(��������Ũ����10-5mol��L-1)����Һ�з�����Ũ��������____________mol��L-1��(���������λ��Ч���֣���֪![]() =1.36)
=1.36)
(6)��֪��Ksp(BaCO3)=2.58��10-9��Ksp(BaSO4)=1.07��10-9�����Ȼ�����Һ��������ʵ���Ũ�ȵ������ƺ�̼���ƵĻ����Һ�У���BaCO3��ʼ����ʱ����Һ��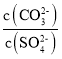 =___________(���������λ��Ч����)��
=___________(���������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ��װ�õĿ�ѧ�����ʵ���Ƿ�ȡ��Ԥ��Ч���Ĺؼ�����ش������й�ʵ��װ�õ�������⣺

I��ͼһ��AΪ�̲��Ʊ�����������ʵ��װ�ã���ͬѧ��Ϊͼһ��Bװ�ñ�AҪ�ã�����ȴˮӦ��______�ڽ��룻��ͬѧ��Ϊͼһ��Cװ��Ч�����ã�������_______��
����Ħ������[(NH4)2Fe(SO4)26H2O]�Ƿ�����ѧ�е���Ҫ�Լ�����֪��Ħ���θ�������������500��ʱ����ȫ�ֽ⡣ijѧϰС����̽����ֽ���
��1��[�������]С��ͬѧ��Ϊ�ֽ������������¼��������
A��Fe2O3��SO2��NH3��H2O B��FeO��SO3��NH3��H2O
C��FeO��SO2��NH3��H2O D��Fe2O3��SO3��SO2��NH3��H2O
������ѧ֪ʶ����ȷ��_________������������ţ�
��2��[ҩƷ�鴿]��ͬѧ���������ʪ��ĺ�ɫʯ����ֽ��ϡ�����_________��Һ�������Ħ�������е��������ӣ�ȡһ��������Ħ�����������Һ��ȡ������Һ�����Թ��У������еμ�_______�����Լ����ƺ�ʵ����������Ħ������δ�����������ʡ�
��3��[ʵ��̽��]Ϊ����ֽ�����ͬѧ���������ʵ��װ�á�
��ȡһ������Ħ���������ڼ��ȹ�A�У��������ֽ���ȫ���K����ͨ��N2��Ŀ����________��
��ʵ���й۲쵽A�й�����Ϊ����ɫ��B��C�о�������ɫ������C�з�����Ӧ�����ӷ���ʽΪ________��
��ʵ����֤ȡA�в�������������ϡ�����ܽ⣬�ٵ���KMnO4ϡ��Һ������ɫ֤�����ﲻ��______��
��4��[ʵ������뷴˼]ͨ��ʵ����������淴˼������������һ����ȷ����______��������ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() Ϊ�����ӵ�������ֵ������˵����ȷ����
Ϊ�����ӵ�������ֵ������˵����ȷ����
A.![]() ʱ
ʱ![]() ������¶���
������¶���![]() ������Һ�к���
������Һ�к���![]() ��
��![]()
B.Ǧ���طŵ�ʱ����������������������������![]() ʱ��ת�Ƶ�����Ϊ
ʱ��ת�Ƶ�����Ϊ![]()
C.![]() ����ˮ����Һ��
����ˮ����Һ��![]() ��
��![]() ��
��![]() ������Ϊ
������Ϊ![]()
D.![]() �������
�������![]() ������ը
������ը![]()
![]()
![]() ����ת��
����ת��![]() ������ʱ������
������ʱ������![]() ��״��
��״��![]() �������
�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com