
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.![]() 时
时![]() ,则该温度下
,则该温度下![]() 饱和溶液中含有
饱和溶液中含有![]() 个
个![]()
B.铅蓄电池放电时负极净增质量比正极净增质量多![]() 时,转移电子数为
时,转移电子数为![]()
C.![]() 溶于水,溶液中
溶于水,溶液中![]() 、
、![]() 、
、![]() 的总数为
的总数为![]()
D.![]() 叠氮化铵
叠氮化铵![]() 发生爆炸
发生爆炸![]()
![]()
![]() 。当转移
。当转移![]() 个电子时,产生
个电子时,产生![]() 标准状况
标准状况![]() 混合气体
混合气体
科目:高中化学 来源: 题型:
【题目】常温下,下列关于pH=3的HF溶液的叙述正确的是( )
A.该溶液中由H2O电离出的c(H+)=1.0×10-3 mol·L-1
B.与等体积pH=11的NaOH溶液混合,所得溶液呈中性
C.该溶液中离子浓度大小关系:c(H+)>c(F-)>c(OH-)
D.滴加NaOH溶液至c(F-)=c(Na+)时,溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为______________。
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是______________。
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
装置 | 现象 | 结论及解释 |
| ①A试管中黑色沉淀逐渐溶解 | a.现象②说明黑色沉淀具有_________性。 |
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:__________。
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4﹣+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4﹣+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2溶液反应完全,则混合物中Cu2S 的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液的说法中错误的是( )
A.某温度下纯水中c(OH-)=2×10-7mol·L-1,则该温度下0.1mol·L-1的盐酸的pH=1
B.分别向同体积、同pH的醋酸和盐酸中加入足够的锌粉,两者产生H2的体积一样多
C.浓度相同的①Na2CO3、②Na2SO3、③Na2SO4三种溶液,pH由小到大的顺序是:③<②<①
D.室温下Ksp[R(OH)3]=1×10-38,在c(R3+)=0.01mol·L-1的溶液中,当pH=2时R3+开始沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以黄铜矿为原料,采用火法治铜。其中间过程的一个反应的化学方程式为2Cu2O+Cu2S![]() 6Cu+SO2↑,对于该反应下列说法正确的是
6Cu+SO2↑,对于该反应下列说法正确的是
A.氧化产物是Cu
B.还原剂是![]()
C.生成1molCu转移的电子数为2mol
D.![]() 既是氧化剂也是还原剂
既是氧化剂也是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以![]() 的形式存在,在海水中主要以
的形式存在,在海水中主要以![]() 的形式存在,几种粒子之间有如图所示转化关系.根据图示转化关系推测,下列说法不正确的是
的形式存在,几种粒子之间有如图所示转化关系.根据图示转化关系推测,下列说法不正确的是
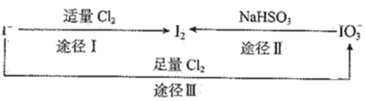
A.可用![]() 淀粉试纸和食醋检验加碘盐中是否含有
淀粉试纸和食醋检验加碘盐中是否含有![]()
B.足量![]() 能使湿润的
能使湿润的![]() 淀粉试纸变白的原因是
淀粉试纸变白的原因是![]()
C.由图可知氧化性的强弱顺序为![]()
D.途径Ⅱ中若生成1molI2,反应中转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)键线式![]() 表示的分子式________;名称是_______________。
表示的分子式________;名称是_______________。
(2)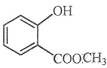 中含有的官能团的名称为________________________。
中含有的官能团的名称为________________________。
(3)写出丁基的4种同分异构体_________________________。
(4)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、____________、______________、尾接管、锥形瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )

Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨氮(NH3、NH![]() )的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
)的处理技术有生物脱氮法、化学沉淀法、折点加氯法和电催化氧化法等。
(1) 氨氮污水直接排放入河流、湖泊导致的环境问题是________。
(2) 生物脱氮法:利用微生物脱氮,原理如下:
NH![]()
![]() NO
NO![]()
![]() N2
N2
反应①的离子方程式为__________________________________。
(3) 化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,NH![]() 转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是________(用离子方程式表示)。
转化为MgNH4PO4·6H2O沉淀。若pH过大,氨氮去除率和磷利用率均降低,其原因是________(用离子方程式表示)。
(4) 折点加氯法:向废水中加入NaClO溶液,使氨氮氧化成N2,相关反应如下:
NaClO+H2O===HClO+NaOH(Ⅰ)
NH3+HClO===NH2Cl+H2O(Ⅱ)
NH2Cl+HClO===NHCl2+H2O(Ⅲ)
NHCl2+H2O===NOH+2HCl(Ⅳ)
NHCl2+NOH===N2↑+HClO+HCl(Ⅴ)
探究NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
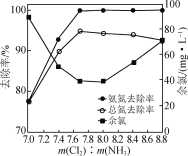
①当m(Cl2)∶m(NH3)≥7.7时,污水中总氮去除率缓慢下降,其原因是__________________。
②当m(Cl2)∶m(NH3)<7.7时,随着m(Cl2)∶m(NH3)的减小,污水中余氯(除Cl-外的氯元素存在形式)浓度升高,其原因是____________________________。
(5) 电催化氧化法:原理如下图所示(MOx表示催化剂)。反应Ⅱ的离子方程式可表示为2NH4++6MOx(·OH)===6MOx+N2↑+6H2O+2H+。
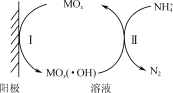
①阳极电极反应式Ⅰ为________________________________。
②电催化氧化法除氨氮时,若其他条件相同时,含Cl-的污水比不含Cl-的污水氨氮去除率要高,其原因是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com