
【题目】碘在地壳中主要以![]() 的形式存在,在海水中主要以
的形式存在,在海水中主要以![]() 的形式存在,几种粒子之间有如图所示转化关系.根据图示转化关系推测,下列说法不正确的是
的形式存在,几种粒子之间有如图所示转化关系.根据图示转化关系推测,下列说法不正确的是
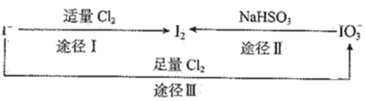
A.可用![]() 淀粉试纸和食醋检验加碘盐中是否含有
淀粉试纸和食醋检验加碘盐中是否含有![]()
B.足量![]() 能使湿润的
能使湿润的![]() 淀粉试纸变白的原因是
淀粉试纸变白的原因是![]()
C.由图可知氧化性的强弱顺序为![]()
D.途径Ⅱ中若生成1molI2,反应中转移的电子数为![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。
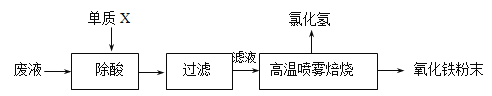
(1)单质X的化学式是___________。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为:_____________________________________________________________________。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3molL-1H2SO4、0.1 molL-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
操作步骤 | 预期现象和结论 |
步骤1.取少量样品于试管中,_______________ | 样品全部溶解,得到澄清的溶液。 |
步骤2.___________________ | __________________ |
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体___升(标准状况),即可得到36.5%的浓盐酸(相对原子质量 Cl 35.5 H 1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电剧、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3, 含有SiO2、Fe2+、Mg2+等杂质)为原料制备氟化钡的流程如下:
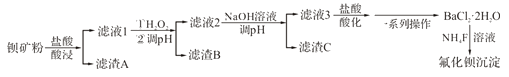
已知:常溫下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
(1)滤渣A的化学式为_________________。
(2)滤液1加H2O2氧化的过程中主要反应的离子方程式为__________________。
(3)加20%NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________。
(4)滤液3加入盐酸酸化后再经__________、冷却结晶、__________、洗涤、真空干燥等一系列操作后得到BaCl2·2H2O。
(5)常温下,用BaCl2·2H2O配制成0.2mol·L-1水溶液与等浓度的氟化铵溶液反应,可得到氯化钡沉淀。 已知Ksp(BaF2)=1.84×l0-7,当钡离子完全沉淀时(即钡离子浓度≤10-5mol·L-1),溶液中氟离子浓度至少是____________mol·L-1。(结果保留三位有效数字,已知![]() =1.36)
=1.36)
(6)已知:Ksp(BaCO3)=2.58×10-9,Ksp(BaSO4)=1.07×10-9。将氯化钡溶液滴入等物质的置浓度的硫酸钠和碳酸钠的混合溶液中,当BaCO3开始沉淀时,溶液中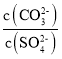 =___________(结果保留三位有效数字)。
=___________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”(NaClO含量为8~10%,另含少量NaCl)置于空气中会逐渐变质,同学们对其成分(水除外)作如下探究:
⑴查阅资料
①“84消毒液”有漂白性和碱性,呈碱性的原因是 ______ (用离子方程式解释)。
电离方程 | H2CO3 | HCO3- | HClO |
电离常数 | K1 =4.4×10-7 | K2 =4.7×10-11 | K =3×10-8 |
②化学上用电离常数衡量弱电解质的电离能力。
③常温下,Ca(ClO)2溶解度为21g;Cl2在饱和食盐水中的溶解度小。
⑵提出假设甲同学根据是否变质和变质情况作出如下假设:
假设一:只含NaCl、NaClO。
假设二:肯定含NaCl,可能含NaClO、NaHCO3、Na2CO3中至少一种,推测含NaHCO3的依据是 ______ (用方程式解释)。
假设三:只含NaCl。
⑶实验验证可选用药品:AgNO3溶液、稀硝酸、澄清石灰水、酚酞、CaCl2溶液
①甲同学取适量“84消毒液”样品于一支试管中,滴加澄清石灰水,出现白色沉淀,判定样品含Na2CO3。
乙同学认为甲的判断不准确,不能仅凭白色沉淀就确定含Na2CO3因为 ______(用离子方程式解释),为此乙同学在甲的基础上继续实验:另取少量样品,滴加CaCl2溶液,无白色沉淀。
②请你设计实验证明假设三不成立______。
③根据上述实验结果,该样品中一定含有______(填化学式)。
⑷定量检测
依据原理:2HCl(浓) + NaClO = NaCl + Cl2↑ + H2O,设计测定NaClO含量的实验如下:
取10g“84消毒液”样品,加足量Ca(OH)2至沉淀完全,过滤并洗涤沉淀,将滤液和洗涤液合并混匀后加入下图装置A中(加热装置已略去),然后加入浓盐酸,当不再有气体生成时,B中得到224 mL液体(折合到标准状况),a仪器的名称是______,实验测得原样品中NaClO的质量分数为 ______。
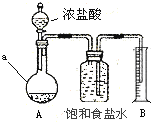
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.![]() 时
时![]() ,则该温度下
,则该温度下![]() 饱和溶液中含有
饱和溶液中含有![]() 个
个![]()
B.铅蓄电池放电时负极净增质量比正极净增质量多![]() 时,转移电子数为
时,转移电子数为![]()
C.![]() 溶于水,溶液中
溶于水,溶液中![]() 、
、![]() 、
、![]() 的总数为
的总数为![]()
D.![]() 叠氮化铵
叠氮化铵![]() 发生爆炸
发生爆炸![]()
![]()
![]() 。当转移
。当转移![]() 个电子时,产生
个电子时,产生![]() 标准状况
标准状况![]() 混合气体
混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:

(1)装置(Ⅱ)中发生反应的化学方程式为 2Fe+3Br2 ═2FeBr3、________ 。
(2)实验开始时,关闭 K2、开启 K1和分液漏斗活塞,滴加苯和液溴的混合液, Ⅲ中小试管内苯的作用是___________。
(3)能说明苯与液溴发生了取代反应的现象是___________。
(4)反应结束后,要让装置I中的水倒吸入装置Ⅱ中,这样操作的目的是___________。简述这一操作的方法:___________ 。
(5)四个实验装置中能起到防倒吸作用的装置有___________。
(6)将装置(Ⅱ)反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液; ②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液; ④加入无水CaCl2粉末干燥;⑤________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() +CH3CHO+HBr
+CH3CHO+HBr![]()
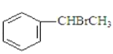 +H2O(卤烷基化反应);
+H2O(卤烷基化反应);
![]() +
+![]()
![]()
![]() +NaX
+NaX
用苯为原料合成化合物Ⅳ的线路如下:
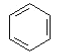
![]() I
I![]()
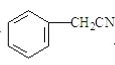
![]() II
II![]() III
III![]() IV(C15H14O2)
IV(C15H14O2)
其中:Ⅱ是羧酸。请回答下列问题:
(1)②的反应类型是________。
(2)写出同时符合下列条件的化合物Ⅱ的同分异构体结构简式(写2种)_____、_____。
a.能与FeCl3溶液作用显紫色;
b.能发生银镜反应;
c.核磁共振氢谱除苯环峰外还有三组峰,峰面积之比为为 1:2:1。
(3)1mol化合物Ⅳ完全燃烧消耗O2_____mol,化合物Ⅳ的结构简式是__________。
(4)化合物Ⅱ与乙醇、浓硫酸共热,合成一种香精原料,试写出该反应的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:A.石墨和金刚石 B. 35Cl和37Cl C.CH3CH=CHCH3和(CH3)2C=CH2 D.丁烷和新戊烷E. 
(1)属于同素异形体的是__________________
(2)属于同位素的是__________________
(3)属于同分异构体的是__________________
(4)属于同系物的是__________________
(5)属于同种物质的是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验符合操作要求且能达到实验目的的是( )
A.I可用于制备氢气并检验其可燃性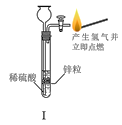
B.II可用于除去CO2中的HCl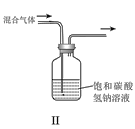
C.Ⅲ可用于配制一定物质的量浓度的NaOH溶液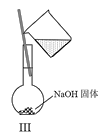
D.IV可用于制备氢氧化亚铁并长时间保存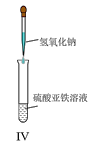
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com