
【题目】下列实验符合操作要求且能达到实验目的的是( )
A.I可用于制备氢气并检验其可燃性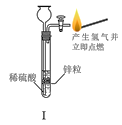
B.II可用于除去CO2中的HCl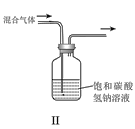
C.Ⅲ可用于配制一定物质的量浓度的NaOH溶液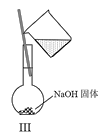
D.IV可用于制备氢氧化亚铁并长时间保存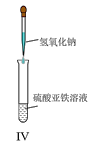
科目:高中化学 来源: 题型:
【题目】“电化学”与人类生产和生活密不可分。
(1)如图为相互串联的甲、乙两个电解池,试回答下列问题。
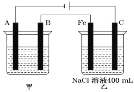
①乙池中若滴入少量酚酞,开始一段时间后,_____电极附近呈红色(填“铁”或“碳”)。
②甲池若为用电解原理精炼铜的装置,A极电极反应式为_____。
③甲池若为用电解原理精炼铜的装置,阴极增重12.8g时,则乙池阳极放出气体在标准状况下的体积为_____(不考虑气体溶解情况)。
(2)人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
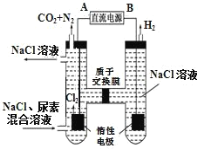
①阳极反应生成的氯气将尿素氧化而得以除去,试写出该反应的化学方程式_____。
②若两极共收集到气体13.44L(标况),则除去的尿素质量为_____ g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若气态烃D的密度为1.25 g/L(标准状况),各种物质间转化关系如下:
A![]() B
B![]() C;A
C;A![]() D
D![]() E。
E。
(1)写出A~E的结构简式:
A_______,B_________,C_________,D_______,E________。
(2)写出下列反应的化学方程式:
A→B:__________________;
B→C:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
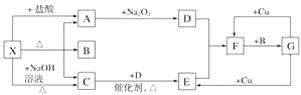
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amol C完全转化为G,理论上至少需要D___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/ |
乙醇 |
| 78.3 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 |
| 77 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制![]() 浓硫酸、
浓硫酸、![]() 乙醇(含
乙醇(含![]() )和
)和![]() 乙酸的混合溶液。
乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热![]() 。
。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
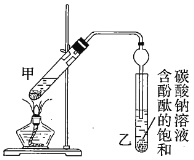
(1)配制①中混合溶液的方法为_______________________________;反应中浓硫酸的作用是____________________________;写出制取乙酸乙酯的反应的化学方程式:____________________________(标出![]() )。
)。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因是____________________________;步骤③所观察到的现象是_______________________________________;欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有___________;分离时,乙酸乙酯应从仪器_____________(填“下口放”或“上口倒”)出。
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如下表:
实验 | 乙醇/ | 乙酸/ | 乙酸乙酯/ |
① | 2 | 2 | 1.33 |
② | 3 | 2 | 1.57 |
③ | 4 | 2 | x |
④ | 5 | 2 | 1.76 |
⑤ | 2 | 3 | 1.55 |
表中数据x的范围是__________________;实验①②⑤探究的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述①能使酸性KMnO4溶液褪色、②可发生加聚反应、③可溶于水、④可溶于苯中、⑤能与浓硝酸发生取代反应、⑥所有的原子可能共平面,其中正确的是( )
)的下列叙述①能使酸性KMnO4溶液褪色、②可发生加聚反应、③可溶于水、④可溶于苯中、⑤能与浓硝酸发生取代反应、⑥所有的原子可能共平面,其中正确的是( )
A.仅①②④⑤B.仅①②⑤⑥C.仅①②④⑤⑥D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的许多化合物在生产、生活中有着广泛的应用,如FeCl3是重要的金属蚀刻剂、水处理剂;影视作品拍摄中常用Fe(SCN)3溶液模拟血液;FeS可用于消除水中重金属污染等。
(1)已知:①3Cl2(g)+2Fe(s)=2FeCl3(s) ΔH1=akJ·mol-1
②2FeCl2(s)+Cl2(g)=2FeCl3(s) ΔH2=bkJ·mol-1
则2FeCl3(s)+Fe(s)=3FeCl2(s) ΔH3=____。
(2)将c(FeCl3)=0.2mol·L-1的溶液与c(KSCN)=0.5mol·L-1的溶液按等体积混合于某密闭容器发生反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
Fe(SCN)3+3KCl,测得常温下溶液中c(Fe3+)的浓度随着时间的变化如图1所示;测得不同温度下t1时刻时溶液中c[Fe(SCN)3]如图2所示。
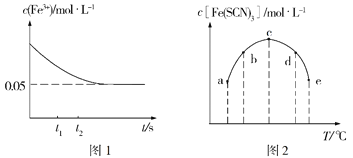
①研究表明,上述反应达到平衡后,向体系中加入适量KCl固体后,溶液颜色无变化,其原因是___,根据图1分析,在t1、t2时刻,生成Fe3+的速率较大的是____时刻。
②常温下Fe3++3SCN-![]() Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
Fe(SCN)3的平衡常数的值约为___,其它条件不变时,若向容器中加适量蒸馏水,则新平衡建立过程中v(正)___v(逆)(填“>”“<”或“=”)。
③根据图2判断,该反应的ΔH___0(填“>”或“<”),图中五个点对应的状态中,一定处于非平衡态的是___(填对应字母)。
(3)利用FeS可除去废水中的重金属离子,如用FeS将Pb2+转化为PbS可消除Pb2+造成的污染,当转化达到平衡状态时,废水中c(Fe2+)=___c(Pb2+)[填具体数据,已知Ksp(PbS)=8×10-28,Ksp(FeS)=6×10-18]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com