
【题目】“84消毒液”(NaClO含量为8~10%,另含少量NaCl)置于空气中会逐渐变质,同学们对其成分(水除外)作如下探究:
⑴查阅资料
①“84消毒液”有漂白性和碱性,呈碱性的原因是 ______ (用离子方程式解释)。
电离方程 | H2CO3 | HCO3- | HClO |
电离常数 | K1 =4.4×10-7 | K2 =4.7×10-11 | K =3×10-8 |
②化学上用电离常数衡量弱电解质的电离能力。
③常温下,Ca(ClO)2溶解度为21g;Cl2在饱和食盐水中的溶解度小。
⑵提出假设甲同学根据是否变质和变质情况作出如下假设:
假设一:只含NaCl、NaClO。
假设二:肯定含NaCl,可能含NaClO、NaHCO3、Na2CO3中至少一种,推测含NaHCO3的依据是 ______ (用方程式解释)。
假设三:只含NaCl。
⑶实验验证可选用药品:AgNO3溶液、稀硝酸、澄清石灰水、酚酞、CaCl2溶液
①甲同学取适量“84消毒液”样品于一支试管中,滴加澄清石灰水,出现白色沉淀,判定样品含Na2CO3。
乙同学认为甲的判断不准确,不能仅凭白色沉淀就确定含Na2CO3因为 ______(用离子方程式解释),为此乙同学在甲的基础上继续实验:另取少量样品,滴加CaCl2溶液,无白色沉淀。
②请你设计实验证明假设三不成立______。
③根据上述实验结果,该样品中一定含有______(填化学式)。
⑷定量检测
依据原理:2HCl(浓) + NaClO = NaCl + Cl2↑ + H2O,设计测定NaClO含量的实验如下:
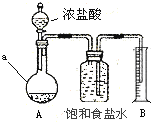
取10g“84消毒液”样品,加足量Ca(OH)2至沉淀完全,过滤并洗涤沉淀,将滤液和洗涤液合并混匀后加入下图装置A中(加热装置已略去),然后加入浓盐酸,当不再有气体生成时,B中得到224 mL液体(折合到标准状况),a仪器的名称是______,实验测得原样品中NaClO的质量分数为 ______。
【答案】ClO- + H2O ![]() HClO + OH- HClO + CO32-
HClO + OH- HClO + CO32- ![]() ClO- + HCO3- 2HCO3- + Ca2+ +2OH- = 2H2O + CaCO3↓+ CO32- 继续加入石灰水出现白色沉淀证明假设三不成立 NaHCO3 圆底烧瓶 7.45%
ClO- + HCO3- 2HCO3- + Ca2+ +2OH- = 2H2O + CaCO3↓+ CO32- 继续加入石灰水出现白色沉淀证明假设三不成立 NaHCO3 圆底烧瓶 7.45%
【解析】
⑴“84消毒液”呈碱性的原因是次氯酸根离子水解显碱性。
⑵电离平衡常数数值分析可知,碳酸钠和次氯酸反应生成碳酸氢钠。
⑶①滴加澄清石灰水与碳酸钠反应生成CaCO3;②向少量样品中滴加CaCl2溶液,无白色沉淀,再在上述得到溶液中加入氢氧化钙溶液出现沉淀;③二氧化碳和次氯酸钠溶液反应生成碳酸氢钠和次氯酸。
⑷装置图分析可知,得知a仪器的名称;再根据关系式进行计算。
⑴“84消毒液”(NaClO含量为8~10%,另含少量NaCl)呈碱性的原因是次氯酸根离子水解显碱性,反应的离子方程式为:ClO- + H2O ![]() HClO + OH-;故答案为:ClO- + H2O
HClO + OH-;故答案为:ClO- + H2O ![]() HClO + OH-。
HClO + OH-。
⑵推测含NaHCO3的依据是变质是二氧化碳和次氯酸钠反应,电离平衡常数数值分析可知,碳酸钠和次氯酸反应生成碳酸氢钠,HClO + CO32- ![]() ClO- + HCO3-;故答案为:HClO + CO32-
ClO- + HCO3-;故答案为:HClO + CO32- ![]() ClO- + HCO3-。
ClO- + HCO3-。
⑶①取适量“84消毒液”样品于一支试管中,滴加澄清石灰水,出现白色沉淀,可能是碳酸钠反应生成,也可能是碳酸氢钠反应生成,滴入氢氧化钙,是少量,所以反应的离子方程式为:2HCO3- + Ca2+ +2OH- = 2H2O + CaCO3↓+ CO32-,故答案为;2HCO3- + Ca2+ +2OH- = 2H2O + CaCO3↓+ CO32-。
②另取少量样品,滴加CaCl2溶液,无白色沉淀,说明样品中没有CO32-,在上述得到溶液中加入氢氧化钙溶液出现沉淀证明样品中有HCO3-,证明假设三错误,故答案为:继续加入石灰水出现白色沉淀证明假设三不成立。
③二氧化碳和次氯酸钠溶液反应生成碳酸氢钠和次氯酸,变质样品一定含有碳酸氢钠,化学式为NaHCO3,故答案为:NaHCO3。
⑷装置图分析可知,a仪器的名称是圆底烧瓶;测定B中体积为生成氯气的体积,物质的量![]() ,根据反应的方程式:2HCl(浓) + NaClO = NaCl + Cl2↑ + H2O可知,n(NaClO)=0.01mol,所以样品中次氯酸钠质量分数
,根据反应的方程式:2HCl(浓) + NaClO = NaCl + Cl2↑ + H2O可知,n(NaClO)=0.01mol,所以样品中次氯酸钠质量分数![]() ,故答案为:圆底烧瓶;7.45%。
,故答案为:圆底烧瓶;7.45%。


科目:高中化学 来源: 题型:
【题目】碘与氢气在一定条件下反应的热化学方程式如下:
(Ⅰ)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(Ⅱ)I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A. 在一定条件下将2 g H2(g)通入254 g I2(g)中,该过程放出的热量为9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C. 反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D. 物质的量相同时,反应(Ⅰ)的反应物总能量比反应(Ⅱ)的反应物总能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜和氯化亚铜都是重要的化原料,常用作石油工业脱臭脱硫和纯化剂、印染媒染剂等。某研究小组用粗铜(含杂质Fe)为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制各CuCl。
[制备CuCl2·2H2O晶体]

(1)仪器B的名称是________________;B中反应的离子方程式为_______________________________。
(2)装置C中粗铜粉末与气体充分反应时的生成物是______________________(填化学式)。反应完成后,将C中的固体用稀盐酸完全溶解、再加入试剂M除杂,经一系列操作便可获得CuCl2·2H2O晶体。
①试剂M应当选用___________(填正确答案字母编号)
a.Cu(NO3)2 b.NaOH c.CuO d.NH3·H2O e.Cu(OH)2
②溶解C中生成物固体时,有时会加入少量双氧水,目的是____________________。
③设计简易实验方案确定所CuCl2·2H2O晶体中不含铁化合物:________________________。
[制备CuCl固体]
将CuCl2·2H2O晶体在HCl气流中加热到140℃得无水CuCl2,再加热到300℃以上可获得CuCl固体。
(3)将CuCl2·2H2O晶体在HCl气流中加热脱水的原因是__________________。
(4)为测定CuCl固体的产率,进行如下定量分析:
①将10.26gCuCl2·2H2O晶体先加热到140℃,再加热到300℃以上,充分反应后,将所得固休平均三份,分别转移至三个锥形瓶中。
②分别在三个锥形瓶中加过量FeCl3溶液不断振荡,使固体迅速溶解,再加入2滴1,10—邻菲啰啉一硫酸亚铁络合物作指示剂。
③用1.00mol/L的硫酸铈[Ce(SO4)2]标准液进行滴定。平行测定三份样品溶液,消耗硫酸铈[Ce(SO4)2]标准溶液的平均体积为19.40mL。
反应原理:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Ce3++Fe3+
根据上述定量实验计算CuCl的产率为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 有机物![]() 属于芳香烃,含有两种官能团
属于芳香烃,含有两种官能团
B. 按系统命名法,化合物![]() 的名称为2,4,6-三甲基-5-乙基庚烷
的名称为2,4,6-三甲基-5-乙基庚烷
C. 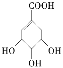 既属于醇类又属于羧酸
既属于醇类又属于羧酸
D. 2-甲基-3-丁烯的命名错误原因是选错了主链
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液的说法中错误的是( )
A.某温度下纯水中c(OH-)=2×10-7mol·L-1,则该温度下0.1mol·L-1的盐酸的pH=1
B.分别向同体积、同pH的醋酸和盐酸中加入足够的锌粉,两者产生H2的体积一样多
C.浓度相同的①Na2CO3、②Na2SO3、③Na2SO4三种溶液,pH由小到大的顺序是:③<②<①
D.室温下Ksp[R(OH)3]=1×10-38,在c(R3+)=0.01mol·L-1的溶液中,当pH=2时R3+开始沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以![]() 的形式存在,在海水中主要以
的形式存在,在海水中主要以![]() 的形式存在,几种粒子之间有如图所示转化关系.根据图示转化关系推测,下列说法不正确的是
的形式存在,几种粒子之间有如图所示转化关系.根据图示转化关系推测,下列说法不正确的是
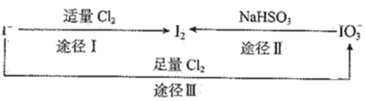
A.可用![]() 淀粉试纸和食醋检验加碘盐中是否含有
淀粉试纸和食醋检验加碘盐中是否含有![]()
B.足量![]() 能使湿润的
能使湿润的![]() 淀粉试纸变白的原因是
淀粉试纸变白的原因是![]()
C.由图可知氧化性的强弱顺序为![]()
D.途径Ⅱ中若生成1molI2,反应中转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物可能为
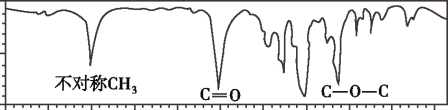
A.CH3COOCH2CH3B.CH3CH2COOH
C.HCOOCH2CH2CH3D.(CH3)2CHCH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g) ![]() 2NO2(g)+S(s)。
2NO2(g)+S(s)。
改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是( )
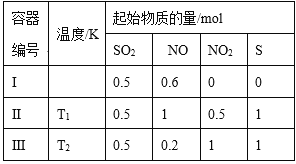

A.该反应的ΔH<0
B.T1时,该反应的平衡常数为![]()
C.容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2
D.若T2<T1,达到平衡时,容器Ⅲ中NO的体积分数小于40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com