
【题目】常温下,下列关于pH=3的HF溶液的叙述正确的是( )
A.该溶液中由H2O电离出的c(H+)=1.0×10-3 mol·L-1
B.与等体积pH=11的NaOH溶液混合,所得溶液呈中性
C.该溶液中离子浓度大小关系:c(H+)>c(F-)>c(OH-)
D.滴加NaOH溶液至c(F-)=c(Na+)时,溶液pH=7
【答案】CD
【解析】
A. HF电离出的H+抑制了水的电离;
B. HF过量,与等体积pH=11的NaOH溶液混合,所得溶液呈酸性;
C.H+除了来自HF电离,还来自水的电离,因此c(H+)>c(F-);
D.根据电荷守恒进行分析。
A. pH=3的HF溶液中,c(H+)=10-3mol/L,电离出的H+抑制了水的电离,溶液中OH-来自水的电离,则由水电离出的c(OH-)=![]() )=
)=![]() =10-11mol/L,A项错误;
=10-11mol/L,A项错误;
B. pH=3的HF溶液与等体积pH=11的NaOH溶液混合,HF为弱酸,混合液中HF过量,反应后所得溶液呈酸性,B项错误;
C. H+除了来自HF电离,还来自水的电离,因此c(H+)>c(F-),溶液中离子浓度的大小关系为:c(H+)>c(F-)>c(OH-),C项正确
D. 根据电荷守恒有c(H+)+ c(Na+)= c(OH-)+ c(F-),滴加NaOH溶液至c(F-)=c(Na+)时可得c(H+)= c(OH-),溶液呈中性,常温下溶液pH=7,D项正确;
答案选CD。


科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
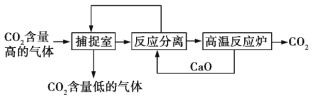
下列有关该方法的叙述中正确的是
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,“捕捉”到的CO2还可用来制备甲醇等产品
A.①③B.②④C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g) ![]() CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
CO2(g)+2H2(g) ΔH>0,有关实验数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
C(s) | H2O(g) | H2(g) | |||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
下列说法正确的是( )
A.T1<T2B.乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol
C.混合气体的密度始终保持不变D.K2=1.35
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、 E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色:反应③中有水生成,反应②需要放电才能发生,A是—种极易溶于水的气体,A和D相遇有白烟生成。
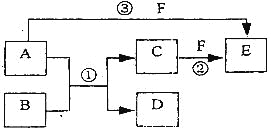
(1)反应③的化学方程式为_______________________________________________。
(2)反应①中每生成1 molC,转移的电子数为_______________________________。
(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈性___________(填“酸”“碱”或“中’’),该水溶液中存在着如下关系,用粒子浓度符号填写:
①c(H+)+_________=c(OH-)+_____________;
②c(H+)=c(OH-)+_____________。
(4)元素X与组成B的元素同周期,X的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式____________________________________;
②X、空气、海水可以组成新型海水标志灯的电池。该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流。则该新型电池的正极的电极反应式为___________________________;原电池的总反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的用法中,正确的是
A. BaCO3的电离方程式:BaCO3![]() Ba2++CO32—
Ba2++CO32—
B. 向沸水中滴加饱和氯化铁溶液得到红褐色液体的化学方程式:3H2O+FeCl3=3HCl+Fe(OH)3↓
C. 向酸性KI溶液中通入臭氧(O3)的离子方程式:2I—+O3+H2O==I2+O2+2OH—
D. 向Ba(OH)2溶液中滴入 NaHSO4溶液至恰好完全沉淀时,反应的离子方程式Ba2++OH—+SO42—+H+==BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。
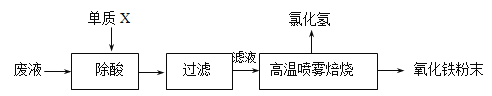
(1)单质X的化学式是___________。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为:_____________________________________________________________________。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3molL-1H2SO4、0.1 molL-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
操作步骤 | 预期现象和结论 |
步骤1.取少量样品于试管中,_______________ | 样品全部溶解,得到澄清的溶液。 |
步骤2.___________________ | __________________ |
(4)请计算,用635g水完全吸收“高温喷雾焙烧”产生的HCl气体___升(标准状况),即可得到36.5%的浓盐酸(相对原子质量 Cl 35.5 H 1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯氧化铜[xCuO·yCuCl2·zH2O]在农业上用作杀菌剂。工业上用铜矿粉(主要含Cu2(OH)2CO3、Fe3O4等)为原料制取氯氧化铜的流程如下:
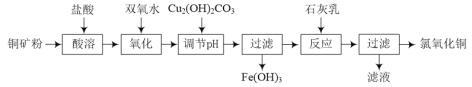
⑴“调节pH”并生成Fe(OH)3时反应的离子方程式为______。
⑵调节pH,要使常温溶液中c(Cu2+)≥0.022mol·L-1,而c(Fe3+)≤1×10-6mol·L-1,则应调节pH的范围为______。{已知Ksp[Cu(OH)2=2.2×10-20],Ksp[Fe(OH)3=1×10-36]}
⑶为测定氯氧化铜的组成,现进行如下实验:
步骤Ⅰ:称取0.4470 g氯氧化铜,放入锥形瓶,加入一定量30%的硝酸使固体完全溶解。滴加K2CrO4溶液作指示剂,用0.1000mol·L-1 AgNO3标准溶液滴定溶液中的Cl-,滴定至终点时消耗AgNO3标准溶液20.00 mL;
步骤Ⅱ:称取0.4470g氯氧化铜,放入锥形瓶,加入一定量硫酸使固体完全溶解。向溶液中加入过量的KI固体,充分反应后向溶液中滴入数滴淀粉溶液,用0.2000mol·L-1Na2S2O3标准溶液滴定,滴定至终点时消耗Na2S2O3标准溶液20.00mL。
已知步骤Ⅱ中所发生的反应如下:
2Cu2++4I-=2CuI↓+I2 2Na2S2O3+I2=2NaI+Na2S4O6
①已知Ag2CrO4为砖红色沉淀,步骤Ⅰ滴定终点时的实验现象是_______。
②通过计算确定氯氧化铜的化学式________________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃的衍生物有多种,按要求回答下列问题:
(1)若分子式为C4H10O并能与金属钠反应放出H2的有机化合物有________种。
(2)与化合物C7H10O2互为同分异构体的物质不可能为________(填序号)。
A.醇 B.醛 C.羧酸 D.酚
(3)与![]() 具有相同官能团的同分异构体的结构简式为______________(写出一种即可)。
具有相同官能团的同分异构体的结构简式为______________(写出一种即可)。
(4)苯氧乙酸(![]() )有多种酯类的同分异构体。其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是________(写出任意两种的结构简式)。
)有多种酯类的同分异构体。其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是________(写出任意两种的结构简式)。
(5)分子式为C5H10的烯烃共有(不考虑顺反异构)__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A.![]() 时
时![]() ,则该温度下
,则该温度下![]() 饱和溶液中含有
饱和溶液中含有![]() 个
个![]()
B.铅蓄电池放电时负极净增质量比正极净增质量多![]() 时,转移电子数为
时,转移电子数为![]()
C.![]() 溶于水,溶液中
溶于水,溶液中![]() 、
、![]() 、
、![]() 的总数为
的总数为![]()
D.![]() 叠氮化铵
叠氮化铵![]() 发生爆炸
发生爆炸![]()
![]()
![]() 。当转移
。当转移![]() 个电子时,产生
个电子时,产生![]() 标准状况
标准状况![]() 混合气体
混合气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com