
【题目】下列表示反应中电子转移的方向和数目正确的是( )
A.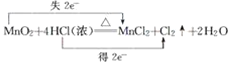
B.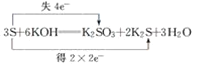
C.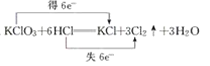
D.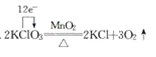
【答案】B
【解析】
A.在该反应中Mn元素的化合价由MnO2中的+4价变为MnCl2中的+2价,化合价降低,获得2e-,Cl元素的化合价由反应前HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去2×e-,A错误;
B.在该反应中只有S元素化合价的升降,电子得失与元素化合价升降符合氧化还原反应规律,B正确;
C.在该反应中Cl元素的化合价由KClO3中的+5价变为Cl2中的0价,化合价降低,获得5e-,Cl元素的化合价由反应前HCl中的-1价变为反应后Cl2中的0价,化合价升高,失去5×e-,电子转移数目及反应原理不符合反应事实,C错误;
D.在用单线桥法表示时,电子由失去电子的元素O指向得到电子的元素Cl,电子转移数目为6×2e-,D错误;
故合理选项是B。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】工业上以乙苯催化脱氢制取苯乙烯的反应如下:
![]() (g)
(g)![]() (g)+H2(g)
(g)+H2(g)
现将x mol乙苯蒸气通入体积可变的密闭容器中反应,维持体系总压强p总恒定。在某催化剂作用下,乙苯的平衡转化率随温度变化如图所示。

已知:气体分压(p分)= 气体总压(p总)×体积分数。不考虑副反应,下列说法正确的是
A.400℃时,向体系中通入水蒸气,v(正)、v(逆) 均减小,且乙苯转化率降低
B.500℃时,向体系中通入乙苯、苯乙烯、氢气各0.1x mol,平衡不移动
C.550℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=![]() × p总
× p总
D.550℃时平衡体系中苯乙烯的体积分数是450℃时的3倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度压强下,用相同质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是

A. 气球B中装的是O2B. 气球A和气球D中气体物质的量之比为4:1
C. 气球A和气球C中气体分子数相等D. 气球C和气球D中气体密度之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于mg H2和ng He的下列说法正确的是( )
A.同温同压下,H2和He的体积比为m:2n
B.同温同压下,若m=n,则H2与He的物质的量比为2:1
C.体积相同时,He的质量一定大于H2
D.若二者的物质的量相等,其体积也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验:
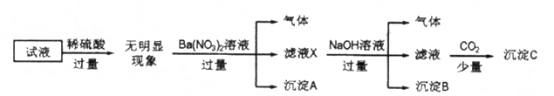
下列说法正确的是
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
D. 无法确定沉淀C的成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Ca(OH)2、NaAlO2、NaOH配成100.0mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的体积(标准状况下)V(CO2)的关系,如图所示,下列说法中正确的是( )
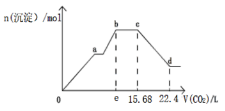
A. 混合溶液中c(NaOH)+c(NaAlO2)=0.4mol/L
B. e点的值为11.2
C. cd段表示Al(OH)3沉淀溶解
D. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

① 第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
② 1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是_______________________。
(aq)的热化学方程式是_______________________。
(2) 已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4) 已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1 ②
O2(g) ΔH=-226 kJ·mol-1 ②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________________。
(5) 已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断 裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如下图所示,M、N为离子交换膜。
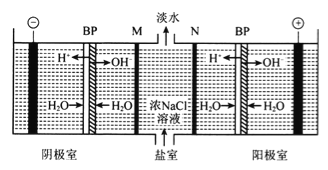
下列说法错误的是
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有C12生成
D. 电路中每转移1mol电子,两极共得到0.5 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是SO2(g)和O2(g)反应生成SO3(g)的能量变化示意图,由图可知( )
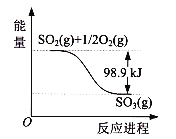
A. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= -197.8 kJ/mol
2 SO3(g) △H= -197.8 kJ/mol
B. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= +197.8 kJ/mol
2 SO3(g) △H= +197.8 kJ/mol
C. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= +98.9 kJ/mol
2 SO3(g) △H= +98.9 kJ/mol
D. 2 SO2(g)+ O2(g)![]() 2 SO3(g) △H= -98.9 kJ/mol
2 SO3(g) △H= -98.9 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com