
【题目】碳酸氢钠是一种重要的化工原料,在日常生活中也有广泛的用途,侯德榜先生发明了连续生产纯碱与氯化铵的联合制碱工艺,成为近代化学工业的奠基人之一,该反应原理为:![]() 饱和
饱和![]() .
.
现用如图所示装置和上述原理制取碳酸氢钠晶体,图中夹持装置已略去.
可选用的药品有:①石灰石②生石灰③![]() 盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液

请回答下列问题
(1)仪器a的名称是______.
(2)![]() 中应选用的药品是______
中应选用的药品是______![]() 填序号
填序号![]()
(3)在实验过程中,应先向C中通入的气体的化学式是______,其原因是______.
(4)![]() 中脱脂棉应浸润的试剂是______
中脱脂棉应浸润的试剂是______![]() 填写字母编号
填写字母编号![]()
![]() 浓硫酸
浓硫酸 ![]() 稀硫酸
稀硫酸 ![]() 氢氧化钠溶液
氢氧化钠溶液 ![]() 浓硝酸
浓硝酸
(5)该小组同学为了测定C中所得晶体中碳酸氢钠的纯度![]() 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质![]() ,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:
,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:

![]() 操作Ⅲ中的方法是______,______,______
操作Ⅲ中的方法是______,______,______
![]() 所得晶体中碳酸氢钠的纯度是______
所得晶体中碳酸氢钠的纯度是______![]() 不必化简
不必化简![]()
【答案】圆底烧瓶 ⑦ ![]()
![]() 在水中溶解度小,先通
在水中溶解度小,先通![]() 至饱和,有利于
至饱和,有利于![]() 析出 b 过滤 洗涤 干燥
析出 b 过滤 洗涤 干燥 ![]()
【解析】
![]() 根据常用的仪器名称解答;
根据常用的仪器名称解答;
![]() 装置的作用为除去二氧化碳中的氯化氢,二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳;
装置的作用为除去二氧化碳中的氯化氢,二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳;
![]() 根据二氧化碳和氨气的溶解性判断先通入的气体,氨气极易溶于水,易于二氧化碳的吸收,所以应先通入氨气;
根据二氧化碳和氨气的溶解性判断先通入的气体,氨气极易溶于水,易于二氧化碳的吸收,所以应先通入氨气;
![]() 氨气易挥发,氨气为碱性气体,与酸反应、与碱不反应,浓硫酸具有强氧化性,浓硝酸易挥发;
氨气易挥发,氨气为碱性气体,与酸反应、与碱不反应,浓硫酸具有强氧化性,浓硝酸易挥发;
![]() 测定C中所得晶体的碳酸氢钠的纯度
测定C中所得晶体的碳酸氢钠的纯度![]() 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质![]() ,将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氢氧化钡溶液,氢氧化钡跟碳酸钠反应生成碳酸钡,将生成的碳酸钡过滤、洗涤、干燥,称量为ng,根据关系式
,将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氢氧化钡溶液,氢氧化钡跟碳酸钠反应生成碳酸钡,将生成的碳酸钡过滤、洗涤、干燥,称量为ng,根据关系式![]() --
--![]() 可求出纯碳酸氢钠的质量。
可求出纯碳酸氢钠的质量。
![]() 装置为制取二氧化碳的装置,仪器a为圆底烧瓶,故答案为:圆底烧瓶;
装置为制取二氧化碳的装置,仪器a为圆底烧瓶,故答案为:圆底烧瓶;
![]() 装置的作用为除去二氧化碳中的氯化氢,二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳,所以B中盛有试剂为饱和碳酸氢钠溶液,
装置的作用为除去二氧化碳中的氯化氢,二氧化碳在饱和碳酸氢钠溶液中溶解度不大,氯化氢能够与碳酸氢钠反应生成二氧化碳,所以B中盛有试剂为饱和碳酸氢钠溶液,
故答案为:![]() ;
;
![]() 在水中溶解度小,氨气极易溶于水,则先通
在水中溶解度小,氨气极易溶于水,则先通![]() 至饱和,然后通入二氧化碳气体,有利于
至饱和,然后通入二氧化碳气体,有利于![]() 析出,
析出,
故答案为:![]() ;
;![]() 在水中溶解度小,先通
在水中溶解度小,先通![]() 至饱和,有利于
至饱和,有利于![]() 析出;
析出;
![]() 氨气易挥发,D中脱脂棉应浸润的试剂吸收逸出的氨气,浓硫酸能使棉花脱水、浓硝酸具有挥发性,氨气为碱性气体,与硫酸反应,所以选择稀硫酸,
氨气易挥发,D中脱脂棉应浸润的试剂吸收逸出的氨气,浓硫酸能使棉花脱水、浓硝酸具有挥发性,氨气为碱性气体,与硫酸反应,所以选择稀硫酸,
故答案为:b;
![]() 测定C中所得晶体的碳酸氢钠的纯度
测定C中所得晶体的碳酸氢钠的纯度![]() 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质![]() ,将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氢氧化钡溶液,氢氧化钡跟碳酸钠反应生成碳酸钡,将生成的碳酸钡过滤、洗涤、干燥,称量为
,将晶体充分干燥后,称量质量为wg,此时为碳酸氢钠粗品质量,操作1将晶体加热到质量不再变化时,所得粉末为碳酸钠和杂质,然后溶解,加入氢氧化钡溶液,氢氧化钡跟碳酸钠反应生成碳酸钡,将生成的碳酸钡过滤、洗涤、干燥,称量为![]() ,
,
反应的化学方程式为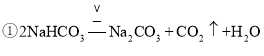 ,
,![]() ,得到的碳酸钡需要经过过滤、洗涤、干燥后方可称量.
,得到的碳酸钡需要经过过滤、洗涤、干燥后方可称量.
设样品中碳酸氢钠的质量为x,由上两式可得关系式:
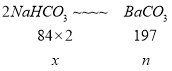
![]() ,
,![]() ,
,
所得晶体中碳酸氢钠的纯度![]() 。
。


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
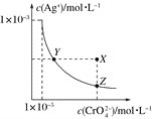
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
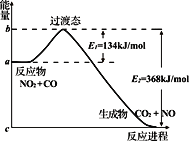
A. 1molNO2与1molCO混合经充分反应放热234 kJ
B. 若反应开始时加入催化剂, 则使E1 、E2 都变大
C. 正反应的活化能是134kJ/mol
D. 该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾( KAl(SO4)2·12H2O)。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
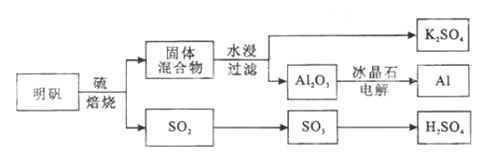
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是__________________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是_____________________。
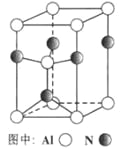
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是____。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是_____________________________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g)![]() 2SO3(g) △H1= 一197 kJ/mol;
2SO3(g) △H1= 一197 kJ/mol;
2H2O (g)=2H2O(1) △H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=一545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是__________________________。
焙烧948t明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在压强为0.1MPa、10L恒容的密闭容器中,将2molCO与5molH2的混合气体在催化剂作用下能生成甲醇CO(g)+2H2(g)=CH3OH(g)△H<0请回答下列问题:
(1)该反应的熵变ΔS_________________0(填“>”、“<”或“=”).
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为_________________mol
②反应的平衡常数K=_________________;
③反应0-5min在区间的平均反应速率v(H2)=_________________
(3)向反应器中再分别充入下列气体,能使CO转化率增大的是_________________
A.CO B.H2 C.CH3OH D.He
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度下,在固定容积的密闭容器中,不能表示反应X(气)+2Y(气)![]() 2Z(气)一定达到化学平衡状态的是( )
2Z(气)一定达到化学平衡状态的是( )
A. 容器内压强不随时间改变B. 容器内混合气体的密度不随时间改变
C. 生成Z的速率与生成Y的速率相等D. 混合气体的平均相对分子质量不随时间改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是( )
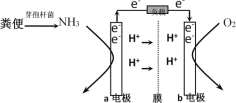
A.a电极是负极,b电极是正极
B.负极区发生的反应是2NH3 - 6e-=N2+6H+
C.正极区,每消耗标准状况下2.24 L O2,a向b电极转移0.4 mol电子
D.电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃的结构简式:__;
(2)聚合物 的单体有___;
的单体有___;
(3)相对分子质量为58的有机化合物A,1mol能与足量银氨溶液作用可析出4molAg,则其结构简式为:__;若该有机物A能与金属钠反应,又能使溴的四氯化碳溶液褪色,则该有机物的结构简式:__。(注:羟基连在双键碳上的有机物极不稳定)
(4)实验室进行以下实验:①石油分馏;②制备乙烯;③制备溴苯 ;④苯的硝化;⑤制备乙酸乙酯。
不需要加热的有___;需要水浴加热的有___;需要温度计的有___;其中温度计插入反应液的有___;需要加碎瓷片的有___;反应中必须加入浓硫酸的有__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com