
【题目】NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,5.6L 一氧化氮和5.6L 氧气混合后的分子总数为0.5NA
B. 等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
C. 一定温度下,1L 0.50 mol/L NH4Cl溶液与2L 0.25 mol/L NH4Cl溶液含NH4+的物质的量不同
D. 标准状况下,等体积的N2和CO所含的原子数均为2NA
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
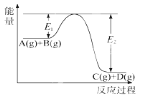
(1)该反应是________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”),原因是________。
(3)反应体系中加入催化剂对反应热是否有影响_______(填“有”、“无”)。
(4)在反应体系中加入催化剂,反应速率增大,此时E1______,E2_______(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为 H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动 物和真菌体中。下列有关判断不正确的是
A.草酸的摩尔质量是 90 g/mol
B.草酸中碳元素的质量分数为 13.3%
C.1 mol 草酸中约含有 6.02×1023 个分子
D.1 mol 草酸在标准状况下的体积约为 22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素 C(又名抗坏血酸,分子式为 C6H8O6)具有较强的还原性,放置在空气中易被氧化,其质量分数可通过在弱酸性溶液中用已知物质的量浓度的 I2 溶液进行测定。该反应 的化学方程式如下:C6H8O6+ I2 = C6H6O6 +2HI。现欲测定某样品中维生素 C 的质量分 数,具体的步骤及测得的数据如下:取10mL6mol/LCH3COOH(提供酸性环境),加入100 mL 蒸馏水,将溶液加热煮沸后放置冷却。精确称取 0.2000g 样品,溶解于上述冷却的 溶液中,立即用物质的量浓度为 0.05000 mol/L 的 I2 溶液进行反应,刚好完全反应时共消耗21.00 mL I2 溶液。
(1)CH3COOH 稀溶液要先经煮沸、冷却后才能使用,煮沸的是为了赶走溶液在溶液中的_____(填物质的化学式)
(2)样品中维生素 C 的质量分数为______。计算过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述错误的是
A. 56 g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
B. 标准状况下22.4L CH4和C2H4的混合气体所含氢原子数为4NA
C. 常温常压下,3.4gNH3中含N—H键数目为0.6NA
D. 1mol 固体NaHSO4含有的阴阳离子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。

(1)写出化学式:A___________B____________J_____________。
(2)反应③中每生成1molF,转移电子的数目为:___________。
(3)反应④的化学方程式为:________________________________________________。
(4)离子方程式分别为:反应②__________________________________________;
⑤__________________________________________________________。
(5)反应①中,每1.00gC与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程式__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组想制取CuO并证明CuO能加快KClO3的分解速率,设计并进行如下实验:
(一)制取CuO
①称取2 g胆矾研细后放入烧杯,加适量蒸馏水溶解;
②向步骤①所得溶液中逐滴加入NaOH溶液至铜离子沉淀完全;
③将步骤②所得沉淀过滤、洗涤,灼烧至恒重,研细备用。
回答下列问题:
(1)上述实验步骤中溶解、过滤时玻璃棒的作用依次是_____________。
(2)步骤③中灼烧前后,沉淀颜色的变化为_______。
(3)利用化学方法证明铜离子已经沉淀完全的操作是____________。
(二)证明CuO能加快KClO3的分解速率,并与MnO2的催化效率进行比较
用下图装置进行实验,且均以生成相同状况下20 mL氧气为准,其它可能影响实验的因素均已忽略,相关数据见下表:

实验序号 | KClO3质量 | 其它物质质量 | 待测数据 |
① | 1.5 g | 无其他物质 | |
② | 1.5 g | CuO 0.5 g | |
③ | 1.5 g | MnO2 0.5 g |
(4)上述实验中的待测数据指_____________;该实验除以上思路外,还可以通过测定______________来比较CuO和MnO2的催化效率。
(5)本实验装置图中量气装置由乳胶管和仪器A_______________(填名称)及50 mL___________(填“酸式”或“碱式”)滴定管改造后组装而成;
(6)为探究CuO在实验②中是否起催化作用,需补做如下实验:
a.CuO的质量有没有改变;
b.CuO的化学性质有没有改变。
简述验证CuO质量是否改变的操作过程_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com