
【题目】在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t ℃时,Ag2CrO4的Ksp为1×10-8
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t ℃时,Y点和Z点时Ag2CrO4的Ksp相等
D. t ℃时,将0.1 mol·L-1 AgNO3滴入20 mL 0.1 mol·L-1 KCl和0.1 mol·L-1 K2CrO4的溶液中,Cl-先沉淀
【答案】A
【解析】根据图像可知,曲线上的点是沉淀溶解平衡点,Ag2CrO4(s)![]() 2Ag++CrO42-,Ksp=c(Ag+)2 c(CrO42-)=(10-3)2×10-5=10-11, A错误;饱和Ag2CrO4溶液中加入K2CrO4,溶液仍为饱和溶液,点仍然在曲线上,不能使溶液由Y点变为X点,B正确;Ksp是温度的函数,t ℃时,Y点和Z点时Ag2CrO4的Ksp相等,C正确;根据溶度积进行计算:Ksp(Ag2CrO4)=10-11,Ksp(AgCl)=1.8×10-10;c(CrO42-)=0.1 mol·L-1,得到c(Ag+)2=10-10,c(Ag+)=10-5 mol·L-1 ;0.1 mol·L-1 KCl溶液中,c(Cl-)=0.1 mol·L-1,根据溶度积进行计算,c(Ag+)=1.8×10-9 mol·L-1,所以氯化银先析出,Cl-先沉淀,D正确;正确选项A。
2Ag++CrO42-,Ksp=c(Ag+)2 c(CrO42-)=(10-3)2×10-5=10-11, A错误;饱和Ag2CrO4溶液中加入K2CrO4,溶液仍为饱和溶液,点仍然在曲线上,不能使溶液由Y点变为X点,B正确;Ksp是温度的函数,t ℃时,Y点和Z点时Ag2CrO4的Ksp相等,C正确;根据溶度积进行计算:Ksp(Ag2CrO4)=10-11,Ksp(AgCl)=1.8×10-10;c(CrO42-)=0.1 mol·L-1,得到c(Ag+)2=10-10,c(Ag+)=10-5 mol·L-1 ;0.1 mol·L-1 KCl溶液中,c(Cl-)=0.1 mol·L-1,根据溶度积进行计算,c(Ag+)=1.8×10-9 mol·L-1,所以氯化银先析出,Cl-先沉淀,D正确;正确选项A。


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A. 分散质粒子直径与分散系种类:![]()
B. NaOH溶液与CO2反应后溶液中的钠盐: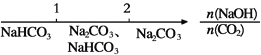
C. AlCl3溶液中滴加NaOH溶液后铝的存在形式:![]()
D. Na与O2反应的产物:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)![]() 2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是( )
2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是( )

A. 乙中5 min内C的反应速率为0.16 mol·L-1·min-1
B. 达到平衡时,丙中A的浓度是甲中的2倍
C. 丙中反应的平衡常数大于甲中反应的平衡常数
D. 达平衡时,甲、乙两容器中C物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是

A. 鲁米诺的化学式为C8H6N3O2
B. 1 mol A分子最多可以与5 mol氢气发生加成反应
C. B中处于同一平面的原子有9个
D. (1)、(2)两步的反应类型分别为取代反应和还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室的硫酸试剂标签上的部分内容。据此,下列说法正确的是
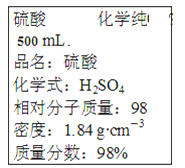
A. 该硫酸的物质的量浓度为9.2mol·L-1
B. 1mol Fe与足量的稀硫酸反应,标准状况下产生44.8L气体
C. 若实验室需要4.6 mol/L的稀硫酸500mL,配制稀硫酸时则应量取该硫酸125.0mL
D. 该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
Ⅱ、以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
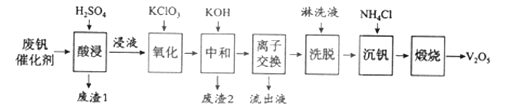
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________
(2)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
III、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:

在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2,回答下列问题:
反应②中发生反应的离子方程式为___________,___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下,反应 X(g)+3Y(g![]() 2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是
2Z(g) △H=-a kJ/mol(a>0 ),某实验小组测得X的转化率(α)在不同温度与压强(P)下 的实验数据,三者之间关系如下图所示。下列说法正确的是

A. 图中a、b两点对应的平衡常数相等
B. 上述反应在达到平衡后,缩小体积,Y的转化率提高
C. 升高温度,正、逆反应速率增大,平衡向正反应方向移动
D. 将2.0molX、6.0molY,置于密闭容器中发生反应,放出的热量为2akJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com