
【题目】在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)![]() 2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是( )
2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是( )

A. 乙中5 min内C的反应速率为0.16 mol·L-1·min-1
B. 达到平衡时,丙中A的浓度是甲中的2倍
C. 丙中反应的平衡常数大于甲中反应的平衡常数
D. 达平衡时,甲、乙两容器中C物质的量相等
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4 , B管中是NaOH溶液,请回答下列问题。
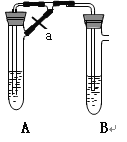
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再 夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为
(3)同学乙打开a的目的 ; (填甲或乙)同学可成功。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态氯原子的价电子排布图是________________________;基态铜原子核外电子占有的空间运动状态有____________种
(2)碳、氮、氧三种元素中第一电离能最大的是____________ (填元素符号)CO32-中碳原子的杂化轨道类型为____________。
(3)相同条件下,水的沸点高于液氨,原因是________________________。
(4)铜与CNˉ可形成络合离子[Cu(CNˉ)4]2-,写出一种与CNˉ互为等电子体的分子的化学式____________;1 mol[ Cu(CNˉ)4]2-中含有____________molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为_________。
(5)氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为__________个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为_________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O) (相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式______________________________________。
(2)步骤③“酸溶”,最适合选用的酸为______________,为提高酸溶速率,可采取的措施是__________(任意写出一条)。
(3)若步骤④沉铅”后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)从原子利用率的角度分析该流程的优点为_______________________。
(5)步骤⑥“合成”三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__ % (结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在300 K时,A(g)+B(g) ![]() 2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
2C(g)+D(s)的化学平衡常数K=4,在该温度下,向1 L容器中加入1 mol A和1 mol B发生反应,下列叙述不能作为该反应达到平衡状态的标志的是
①C的生成速率与C的消耗速率相等 ②单位时间内生成a mol A,同时消耗2a mol C ③A、B、C的浓度不再变化 ④C的物质的量不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的密度不再变化 ⑦A、B、C的分子数之比为1∶1∶2
A. ②⑤ B. ④⑦ C. ②③ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t ℃时,Ag2CrO4的Ksp为1×10-8
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t ℃时,Y点和Z点时Ag2CrO4的Ksp相等
D. t ℃时,将0.1 mol·L-1 AgNO3滴入20 mL 0.1 mol·L-1 KCl和0.1 mol·L-1 K2CrO4的溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷(C3H8)熔融盐燃料电池和锌蓄电池均为用途广泛的直流电源,放电时二者的总反应分别为C3H8+5O2=3CO2+4H2O,2Zn+O2=2ZnO。用丙烷(C3H8)燃料电池为锌蓄电池充电的装置如图所示,下列说法不正确的是

A. 物质M为CO2
B. 燃料电池消耗1mo1 O2时,理论上有4 mol OH-透过b膜向P电极移动
C. a膜、b膜均适宜选择阴离子交换膜
D. 该装置中,锌蓄电池的负极反应式为Zn+2OH--2e-=ZnO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用硫酸银与硫黄培烧制备氧化铝,再电解氧化铝,发生反应如下:反应Ⅰ:2A12(SO4)3+3S![]() 2Al2O3+9SO2↑
2Al2O3+9SO2↑
反应Ⅱ:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
下列说法正确的是
A. 反应Ⅰ中S 单质是氧化剂
B. 反应Ⅱ中铝元素被氧化
C. 当生成5.4gAl时,反应Ⅰ和Ⅱ共转移1.2mole-
D. 反应Ⅰ中氧化产物与还原产物物质的量之比为2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com