
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: 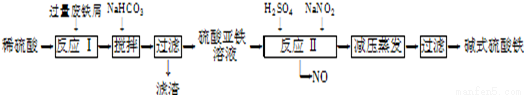
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 ;加入少量NaHCO3的目的是调节pH,使溶液中的
(填“Fe3+”“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 ,若参与反应的O2有11.2L(标准状况),则相当(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成
Fe2(OH)42+ 聚合离子.该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填字母)。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+;Al3+ ;加快反应速率;
(2)氧化剂 2mol
(3)2Fe(OH)2++2H2O Fe2(OH)42++2H+
Fe2(OH)42++2H+
(4)D
【解析】(1)由题意可知,过量废铁屑溶于稀硫酸得FeSO4、Al2(SO4)3混合溶液,使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+;根据表中数据可知,向混合溶液中加入少量NaHCO3,沉淀Al3+而不沉淀Fe2+,反应方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4~7.5之间;工艺中搅拌作用是加快反应速率。
(2)反应Ⅱ是氧化亚铁离子便于铁离子沉淀分离,流程产物分析可知O2与NaNO2在反应中做氧化剂;n(O2)=11.2L/22.4L/mol==0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到2mol电子,NaNO2的物质的量为 2mol.
(3)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+.(4)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子,故A不符合;
B、KSCN溶液和亚铁离子不反应,无现象发生,故B不符合;
C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子,故C不符合;
D、酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色,故D符合。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
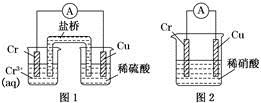
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,加入,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
北京时间2012年9月14日,国外媒体报道,美国宇航局的“好奇”号火星车已经展开它的X射线分析器,并首次完成对火星物质元素成分的分析。下面这张图显示的是α粒子与X射线分光仪从某仪器获得的元素分析数据。多个峰值表明各种成分非常丰富,其中包括在火星大气里发现的氩,该仪器自身的铝,以及火星土壤微粒所含的硫黄和氯.
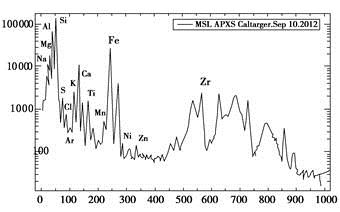
理解此图,判断下列说法错误的是
A.峰值最高的过渡元素在周期表中的位置是第四周期第Ⅷ副族
B.上述元素分析图中,同一周期的两种主族元素可形成1∶1型离子化合物只有一种,其电子式为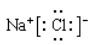
C .氯比硫的非金属性强的依据之一是HCl比H2S稳定
D.工业上常用电解氧化铝的方法制备铝
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
下列各组离子一定能大量共存的是
A.加入铝粉有氢气产生的溶液中Na+ 、K+ 、SO42-、Cl- 、HCO3-
B.含有大量硝酸根离子的溶液中H+ 、Fe2+ 、SO42-、Cl-
、SO42-、Cl-
C.常温下,c(H+)/c(OH-) = 1×10-10 的溶液中NH4+ 、K+ 、Ca2+ 、Cl-
D. 常温下pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
在20 mL 0.1mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是

A.溶液??性时,回滴加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.C点时其pH=5.6,溶质恰好为等物质的量CH3COONa和CH3COOH,则溶液中微粒浓度关系为:c(Na+)>c(CH3COO-)
C.在B点,a>20,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
D.在D点:c(CH3COOH)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:推断题
已知: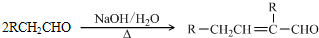
水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下:
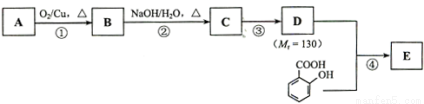
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%。则A的分子式为 ;结构分析显示A只有一个甲基,A的名称为 。
(2)B能与新制的Cu(OH)2发生反应,该反应的化学方程式为 。
(3)C有 种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂 ;
(4)第③的反应类型为 ;D所含官能团的名称为 。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式: 。
A、分子中含有6个碳原子在一条线上
B、分子中所含官能团包括水杨酸具有的官能团
(6)第④步的反应条件为 ;写出E的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:实验题
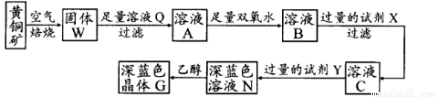
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
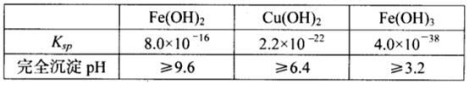
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式 ;
(2)试剂X的化学式为 ,双氧水的作用是 ;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为 ,用pH试纸测该溶液pH值的方法是 ;
(4)在溶液N中加入乙醇的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com