
【题目】苯和甲苯相比较,下列叙述中不正确的是( )
A. 都能使高锰酸钾酸性溶液褪色B. 都属于芳香烃
C. 都能在空气中燃烧D. 都能发生取代反应
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,在周期表中位置如图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是

A. X、Y、Z的原子半径大小:X>Y>Z
B. Y、Z的气态氢化物中,前者更稳定
C. Z、W的最高价氧化物对应水化物的酸性,前者更强
D. X、W的气态氢化物相互反应,生成物中既含离子键又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为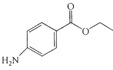 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
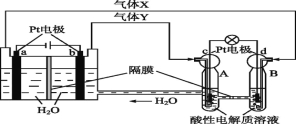
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B中的H+可以通过隔膜进入A
D.d极上发生的电极反应是:O2+4H++4e- =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3Cl)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
(1)甲组同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷。
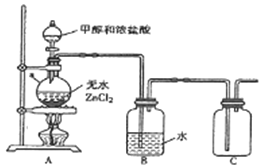
①仪器a的名称为___________。
②无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为_____________。
③装置B的主要作用是_____________。
(2)乙组同学选用甲组A、B装置和下图所示的部分装置检验CH3Cl中的氯元素。
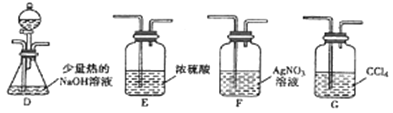
①乙组同学的实验装置中,依次连接的合理顺序为A→B→_____→_____→_____。
②通入一段时间的CH3Cl气体,打开装置D中分液漏斗的活塞先后加入两种试剂,观察实验现象。分液漏斗中先后加入的试剂是_______________。
③能证明CH3Cl中含有氯元素的实验现象是____________。
(3)查阅资料可知:AgNO3的乙醇溶液可以检验CH3Cl中的卤素原子。相关数据如下表:
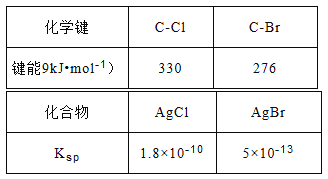
将CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是
A.过氧化钠可用作潜水艇中的供氧剂 B.氧化铝可用于制造耐火坩埚
C.明矾可用作自来水消毒剂 D.铁粉作食品袋内的脱氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;丫与M形成的气态化合物在标准状况下的密度为0.76g·L-1; W的质子数是X、Y、Z、M四种元素质子数之和的![]() ,下列说法正确的是
,下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. YZ2溶于水形成的溶液具有较强的氧化性
C. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
D. 1 molWM溶于足量水中完全反应共转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D,它们的原子序数依次增大。其中A、C与B、D分别是同主族元素。又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍。这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A______;B______;
(2)写出元素D在元素周期表中的位置______;
(3)写出C元素的单质与B元素的单质在常温下反应的化学方程式______;
(4)写出两种均含有A、B、C、D四种元素的化合物相互作用逸出气体的离子方程式______;
(5)A、C组成的化合物,常作为野外考察的取氢(H2)剂。该化合物中加入适量的水,即可形成氢气。写出制氢化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
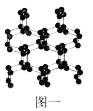
(1)N、O、F三种元素的第一电离能由大到小的顺序为____(填元素符号);与N2互为等电子体的全氧离子化学式为_______;具有空间网状结构的高聚氮结构如图一所示,则N70的沸点_____(填“>”、“<”或“=”)高聚氮的沸点,原因是_________________;N70和高聚氮属于_____(选填序号)。
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3) 等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是____,SO42-的立体构型为___________。
(3)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO2
B. N2H4分子中N原子均采取sp3杂化
C. NaN3的晶格能小于KN3的晶格能
D.上述生成氢叠氮酸的化学方程式为N2H4+HNO2=2H2O+HN3
(4)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V 形,每个氮原子均达到八电子稳定结构,则阳离子的电子式为_______。
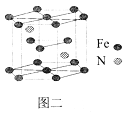
(5)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3, 用NA表示阿伏加德罗常数的值,则该晶体的密度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com